


2023年11月23日,美國(guó)食品藥物管理局(FDA)多個中心或辦公室聯合發(fā)布了題爲《良好(hǎo)實驗室規範(GLP)研究報告翻譯:問題與解答行業指南(草案)》(Translation of Good Laboratory Practice Study Reports: Questions and Answers Guidance for Industry(DRAFT GUIDANCE) )的指南就如何翻譯符合GLP要求的研究報告提供指導性意見,以确保GLP研究報告翻譯的規範性、清晰度和準确度,爲監管決策提供支持。 主要内容包括:
GLP研究報告翻譯稿應當真實、準确、完整地反映原始報告,翻譯人員應當具備相關學(xué)曆和經(jīng)驗; GLP研究報告翻譯稿應當包含翻譯聲明,說明翻譯人員信息、翻譯日期,并證明翻譯版本忠實反映原始報告; 應當建立書面(miàn)翻譯程序,包括翻譯人員資質要求、翻譯過(guò)程文檔化管理要求等; GLP研究報告翻譯稿的最終報告應與原始報告一起(qǐ)保留,報告修訂亦應單獨翻譯; 應當由第二人對(duì)翻譯報告進(jìn)行完整性複核; 翻譯版本無需簽名,但應包含原始報告相關人員姓名和簽名日期。
良好(hǎo)實驗室規範(GLP)研究報告翻譯:問題與解答行業指南(草案)思維導圖 作爲一家立足于爲國(guó)内外客戶提供GLP規範注冊申報服務的CRO,鼎泰集團制定了标準化的GLP研究報告翻譯流程和操作規程,既滿足客戶個性化需求,也滿足監管機構對(duì)翻譯質量的要求。明确了翻譯人員資質要求、翻譯過(guò)程文檔化管理、翻譯正确性核查流程、翻譯版本完整性檢查等。 截至目前,鼎泰集團已協助客戶完成(chéng)30餘項FDA IND申請相關的非臨床研究、SEND數據轉換、報告翻譯和CTD申報文件的搭建,全部一次通過(guò)評審,所涉産品包括小分子化藥、單抗、雙抗、ADC、小核酸和AAV基因治療等藥物。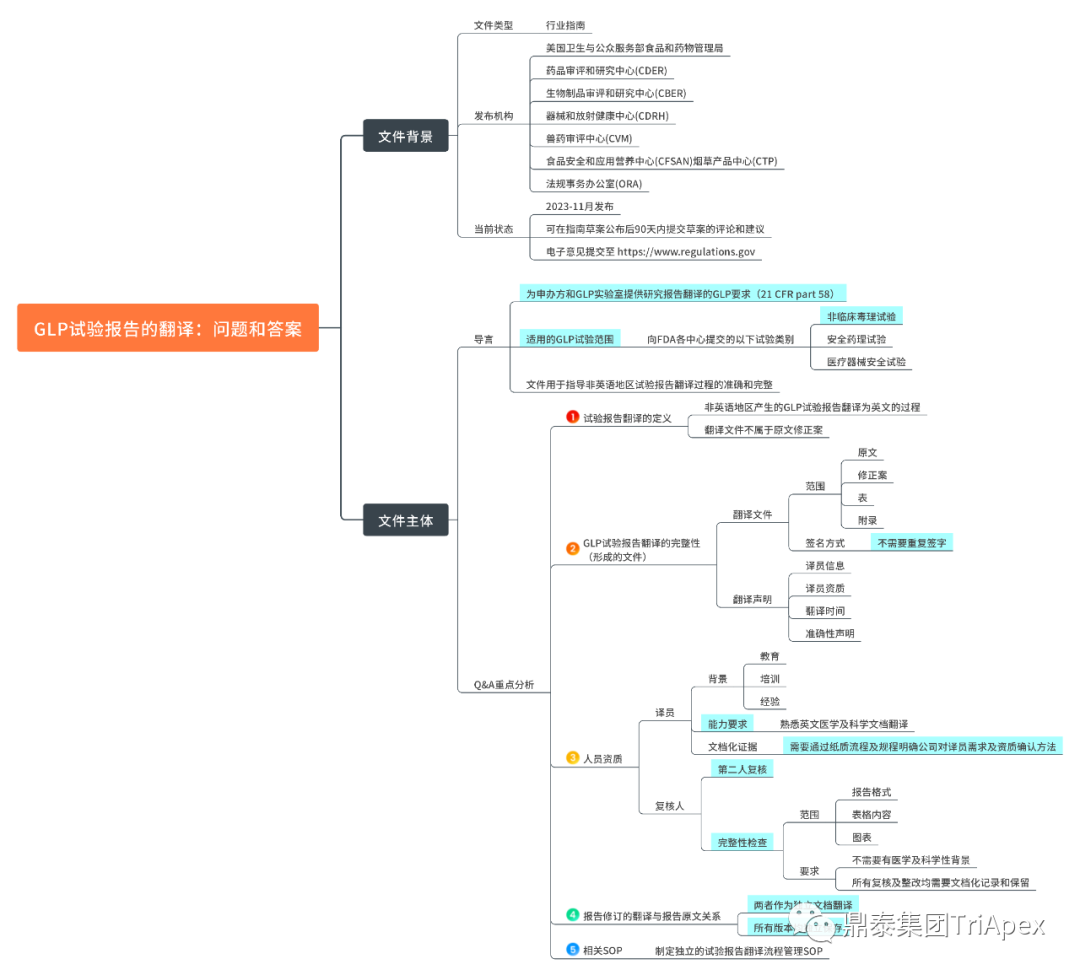
指南草案翻譯:
















掃碼添加好(hǎo)友 可獲取原文件、進(jìn)一步交流












