


關于BA1202及其作用機制
BA1202是國(guó)内首個進(jìn)入臨床階段的CEA/CD3雙特異性抗體,拟用于實體瘤的治療,包括結直腸癌、非小細胞肺癌、胰腺癌和胃癌等CEA陽性腫瘤。
根據博安生物新聞稿,BA1202是靶向(xiàng)CD3和CEA的雙特異性抗體,通過(guò)同時結合T細胞上的CD3和腫瘤細胞的CEA,將(jiāng)T細胞連接到腫瘤細胞從而殺傷腫瘤細胞。CEACAM5(CEA)在結直腸癌、非小細胞肺癌、胰腺癌和胃癌等上皮性腫瘤細胞的表面(miàn)廣泛表達,而在正常組織中表達較少,是腫瘤靶向(xiàng)治療的潛在靶點;CD3是T細胞表面(miàn)的跨膜蛋白,可與T細胞上的TCR結合形成(chéng)受體複合物激活T細胞,并釋放顆粒酶及穿孔素,從而有效殺傷腫瘤細胞。CD3雙抗還(hái)能(néng)增加免疫細胞浸潤腫瘤組織,促進(jìn)“冷腫瘤”轉變爲“熱腫瘤”,提高免疫治療的敏感性,因而具有與免疫檢查點抑制劑聯合增效的潛力。因此,BA1202結構和機制新穎,具備單藥和聯用開(kāi)發(fā)前景。
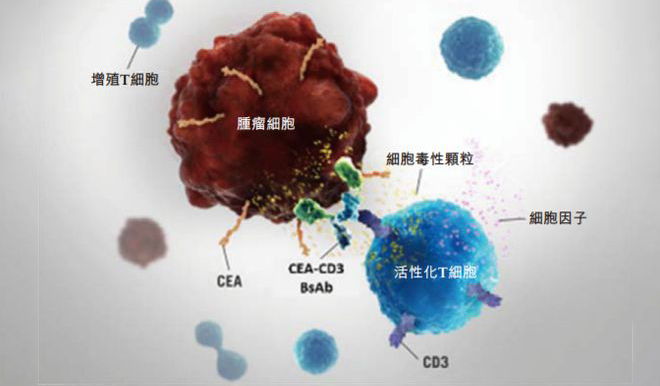
圖片來源博安生物官網
關于 BA1202臨床試驗設計
根據CDE官網公示的臨床試驗信息,該研究爲“一項在晚期實體瘤患者中評價注射用BA1202安全性、耐受性、藥代動力學(xué)和初步療效的多中心、開(kāi)放、單臂、劑量遞增和劑量擴展I期臨床研究”,主要目的是評價注射用BA1202在晚期實體瘤患者中的安全性和耐受性,觀察劑量限制性毒性(DLT),及确定最大耐受劑量(MTD)。研究機構爲中國(guó)醫學(xué)科學(xué)院腫瘤醫院。
根據公示信息,該試驗拟采用靜脈注射給藥。其中,劑量遞增階段共設8個劑量組,每3周給藥一次;劑量擴展階段將(jiāng)根據劑量遞增階段累積的安全性和抗腫瘤療效等數據,選擇1~2個劑量水平進(jìn)行擴展,每3周給藥一次。
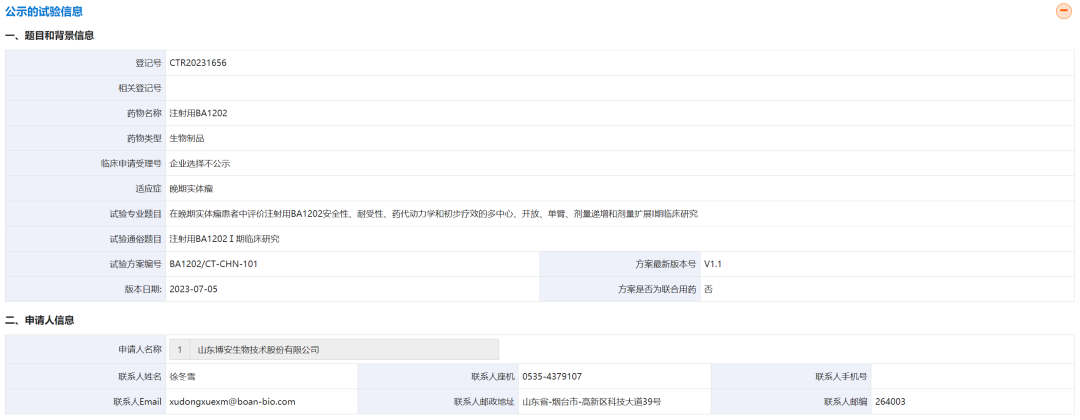
圖片來源CDE官網
臨床前研究提供了重要的臨床轉化價值
鼎泰團隊有幸參與了BA1202項目的臨床前研究,爲BA1202的IND申報和臨床開(kāi)發(fā)貢獻了鼎泰智慧。
BA1202在臨床前研究顯示出良好(hǎo)的安全性。基于對(duì)BA1202産品特點的充分理解和CD3 BiTE非臨床研究的豐富經(jīng)驗,鼎泰團隊完成(chéng)了該産品的臨床前藥代動力學(xué)和安全性評價試驗,爲BA1202提供了合規、高質和高效的服務。以上研究爲BA1202的首次人體臨床試驗方案中關鍵性設計提供了非臨床參考依據,助力該産品完成(chéng)IND申報并順利進(jìn)入臨床。
結語
鼎泰團隊將(jiāng)繼續以專業的技術水平和高效的項目管理體系加快藥物創新轉化,始終緻力于爲全球醫藥企業和科研機構提供一體化的藥物研發(fā)賦能(néng)。
在此,我們衷心地期待BA1202能(néng)夠通過(guò)早期臨床試驗快速完成(chéng)臨床概念驗證(POC),并高效推進(jìn)至後(hòu)期臨床試驗階段,爲結直腸癌、非小細胞肺癌、胰腺癌和胃癌等CEA陽性惡性腫瘤患者提供更爲有效的突破性療法。
關于博安生物


































