


靶點特征及相似靶點産品研究進(jìn)展 PD-1(也稱爲CD279)和CTLA-4(也稱爲CD152),均屬于免疫球蛋白超家族的免疫檢查點分子。腫瘤微環境中的免疫細胞上PD-1和CTLA-4的表達升高,是腫瘤逃脫免疫監視的重要機制。VEGF是VEGF生長(cháng)因子家族的成(chéng)員,VEGF與VEGFR2(KDR)結合後(hòu)可以促進(jìn)血管新生,在腫瘤發(fā)生中起(qǐ)着重要作用。抗血管生成(chéng)藥物與免疫檢查點抑制劑聯合應用可起(qǐ)到協同作用,多個抗血管生成(chéng)劑和ICIs聯合用藥被FDA批準用于腫瘤的治療。 由普米斯生物開(kāi)發(fā)的PM8002爲特異性作用于PD-L1和VEGF的雙特異性抗體,在非臨床研究中表現出較好(hǎo)的開(kāi)發(fā)潛力。早期臨床試驗結果顯示,PM8002在晚期腫瘤患者中的安全性和耐受性均較高;聯合相應的化療方案對(duì)小細胞肺癌(SCLC)和三陰乳腺癌(TNBC)等适應症具有較好(hǎo)的客觀響應率。根據普米斯生物官網信息,普米斯生物已就該産品的全球(大中華區除外)開(kāi)發(fā)、生産和商業化與BioNTech達成(chéng)戰略合作。 由康方生物開(kāi)發(fā)的作用于PD-1和VEGF的雙特異性抗體依沃西單抗(代号AK112)已在國(guó)内開(kāi)展 3 項關鍵性 III 期臨床試驗;其中一項已完成(chéng)并提交上市申請,适應症爲EGFR-TKI 耐藥的 NSCLC二線治療。此外,康方生物已就該産品的國(guó)外開(kāi)發(fā)與Summit Therapeutics 達成(chéng)戰略合作。 由康方生物開(kāi)發(fā)的作用于PD-1和CTLA-4的雙特異性抗體卡度尼利單抗已獲批用于複發(fā)或轉移性宮頸癌的二線治療;用于宮頸癌和胃癌等适應症一線治療的III期臨床試驗已完成(chéng)。
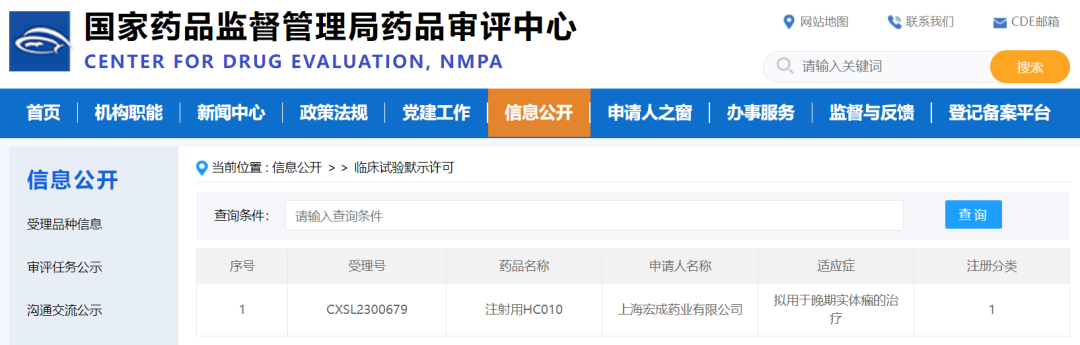
關于注射用HC010及其作用機制 據上海宏成(chéng)藥業新聞稿,注射用HC010是一款靶向(xiàng)人PD-1、CTLA-4和VEGF的三特異性抗體,其設計目的是用于阻斷PD-1與其配體PD-L1/L2、CTLA-4與其配體CD80/CD86以及VEGF與其受體VEGFR2之間的相互作用,同時抑制兩(liǎng)個免疫檢查點和血管新生,從而促進(jìn)抗腫瘤免疫和血管正常化。
鼎泰集團助力HC010等抗體類藥物非臨床研究 鼎泰團隊憑借合規、高質和高效的非臨床研究服務,快速完成(chéng)了HC010三抗的非臨床藥代動力學(xué)、安全性評價(包括一般毒理學(xué)試驗、局部毒性試驗、免疫原性和免疫毒性試驗和、組織交叉反應試驗、體外細胞因子釋放試驗)和安全藥理學(xué)研究,爲該産品申報IND提供了專業、科學(xué)、嚴謹的非臨床研究數據支撐,大大助力了該藥物的臨床轉化進(jìn)程。 在抗體類藥物的非臨床研究方面(miàn),鼎泰團隊已積累豐富的項目經(jīng)驗,項目類型全面(miàn)涵蓋單抗、雙抗及多抗類藥物,最快已支持産品上市,廣泛涵蓋了 VEGF、VEGFR;CD3、4-1BB、PD-1/PD-L1、CTLA-4、TIGIT、LAG3、CCR8、CD25、NKG2A、Siglec15、SIRPα;TSLP、ST2、IL-4Rα、TNFα;CLDN18.2、EGFR、c-Met、HER2、Trop2、DLL3、BCMA、GPRC5D、CD30、CD70、FLT3等熱門靶點,适應症包括腫瘤、自身免疫性疾病、哮喘、眼科疾病、新型冠狀病毒感染、IgA 腎病等多個疾病領域。 ”
推薦閱讀 1、鼎泰助力 | 熱烈祝賀天港醫諾TGI-5單抗獲美國(guó)FDA臨床試驗許可 2、國(guó)内首個!鼎泰集團助力博安生物BA1202獲批進(jìn)入臨床 3、鼎泰助力博安生物首款創新抗體偶聯藥物(ADC)注射用BA1301獲批臨床
關于上海宏成(chéng)藥業


































