


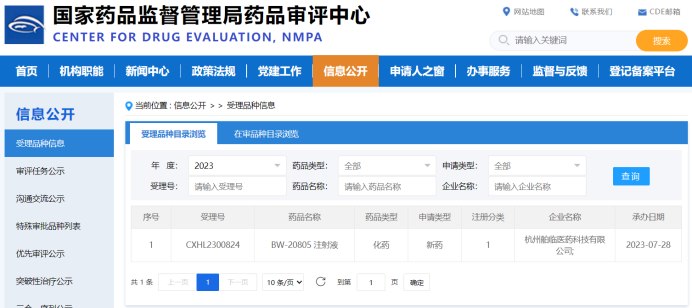
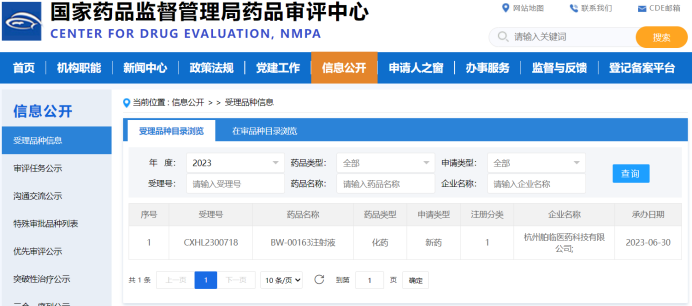
小核酸藥物被譽爲“新藥發(fā)展的第三次浪潮”,有望在更廣泛的疾病治療領域引領未來。鼎泰集團作爲專病領域研發(fā)賦能(néng)的新型CRO,一直緻力于包括小核酸藥物在内的前沿技術藥物的安全性評價研究。目前,已經(jīng)積累了近 10 套siRNA項目的非臨床研究經(jīng)驗,涉及眼科、代謝、CNS等多個疾病領域。根據小核酸藥物本身分子設計的特點,非臨床研究重點關注有各類化學(xué)修飾、核苷酸序列和/或不同遞送系統引起(qǐ)的毒性,并結合藥代動力學(xué)(含組織分布)特征、種(zhǒng)屬相關性、免疫激活特性等方面(miàn)進(jìn)行深度考量,以期加快藥物的快速臨床轉化。
鼎泰集團已在往期文章中對(duì)小核酸藥物非臨床研究相關的安全性、藥代動力學(xué)研究關注點進(jìn)行了深度彙總,點擊文字閱讀文章:
03. 《GalNAc-siRNAs藥物ADME特性及PK-PD模型》
關于遺傳性血管性水腫(HAE)
HAE是一種(zhǒng)常染色體顯性遺傳的、以反複發(fā)作自限性組織水腫爲特征的一種(zhǒng)罕見且嚴重的遺傳病,主要表現爲反複發(fā)生的皮膚、呼吸道(dào)和内髒器官腫脹。當水腫發(fā)生于氣道(dào)時,可緻喉水腫,如果搶救不及時,可窒息死亡;當水腫發(fā)生于胃腸道(dào),會類似急腹症的表現,常誤診爲闌尾炎、急性胰腺炎等,導緻急診進(jìn)行剖腹探查。
HAE的病因是患者血清中C1脂酶抑制因子(一種(zhǒng)α2球蛋白)減少或功能(néng)缺損,以緻C1過(guò)度活化,C4及C2的裂解失控,所生成(chéng)的補體激肽增多,以緻使微血管通透性增高,引起(qǐ)水腫。據相關研究發(fā)現,75%的病例是通過(guò)遺傳發(fā)生,另外25%的發(fā)展是由于基因突變導緻。
目前針對(duì)該疾病僅有一款來自武田制藥的單克隆抗體藥物——拉那利尤單抗注射液在國(guó)内上市。
關于舶望制藥


































