


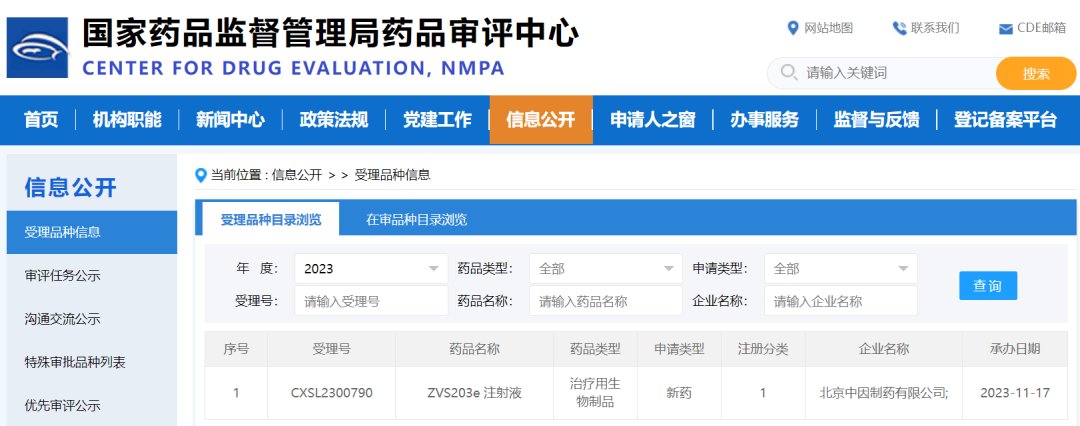
鼎 泰 助 力
鼎泰集團助力ZVS203e注射液非臨床研究 鼎泰團隊高質量、高效率地完成(chéng)了ZVS203e項目用于IND申請的非臨床研究,包括藥代動力學(xué)、毒性試驗和安全藥理研究,以及申報資料的精心撰寫和藥政策略咨詢服務,全力支持其IND申請。精準的眼科給藥技術是開(kāi)展眼科藥物非臨床研究的前提,在ZVS203e項目開(kāi)展中,鼎泰眼科團隊憑借精準的轉基因小鼠視網膜下腔注射方式順利實現給藥,保障了後(hòu)續非臨床研究的可靠性和有效性。此外,眼科團隊已掌握視玻璃體腔注射、球結膜下注射等多種(zhǒng)眼内給藥方式,通過(guò)系統的眼科檢查(裂隙燈、檢眼鏡、OCT、FP、FFA等)、組織病理檢查和安全性評價等,成(chéng)功積累了多項眼科藥物評價經(jīng)驗。 對(duì)于此次ZVS203e注射液獲IND受理的喜訊,鼎泰集團表示熱烈祝賀,也期待不久將(jiāng)再次迎來順利獲批臨床試驗的好(hǎo)消息! ”
關于ZVS203e注射液 據中因科技新聞稿,ZVS203e注射液是一款基于基因編輯技術開(kāi)發(fā)的1類創新藥,用于治療RHO基因變異導緻的視網膜色素變性,是國(guó)内受理的首個體内AAV基因編輯治療産品。 視網膜色素變性(RP)是一種(zhǒng)以感光細胞和色素上皮細胞共同發(fā)生退行性病變爲特征的遺傳性視網膜疾病。大多數患者兒童期或青少年期發(fā)病,臨床初始表現是夜盲,随着病情進(jìn)展視野進(jìn)行性縮小伴中心視力下降,中老年時期影響黃斑而導緻失明。公開(kāi)資料顯示,目前已知RP與超過(guò)100個不同基因的突變相關,具有典型的遺傳異質性,通過(guò)導入正常基因,對(duì)突變基因進(jìn)行替代或表達抑制治療是此領域研究開(kāi)發(fā)的熱點。
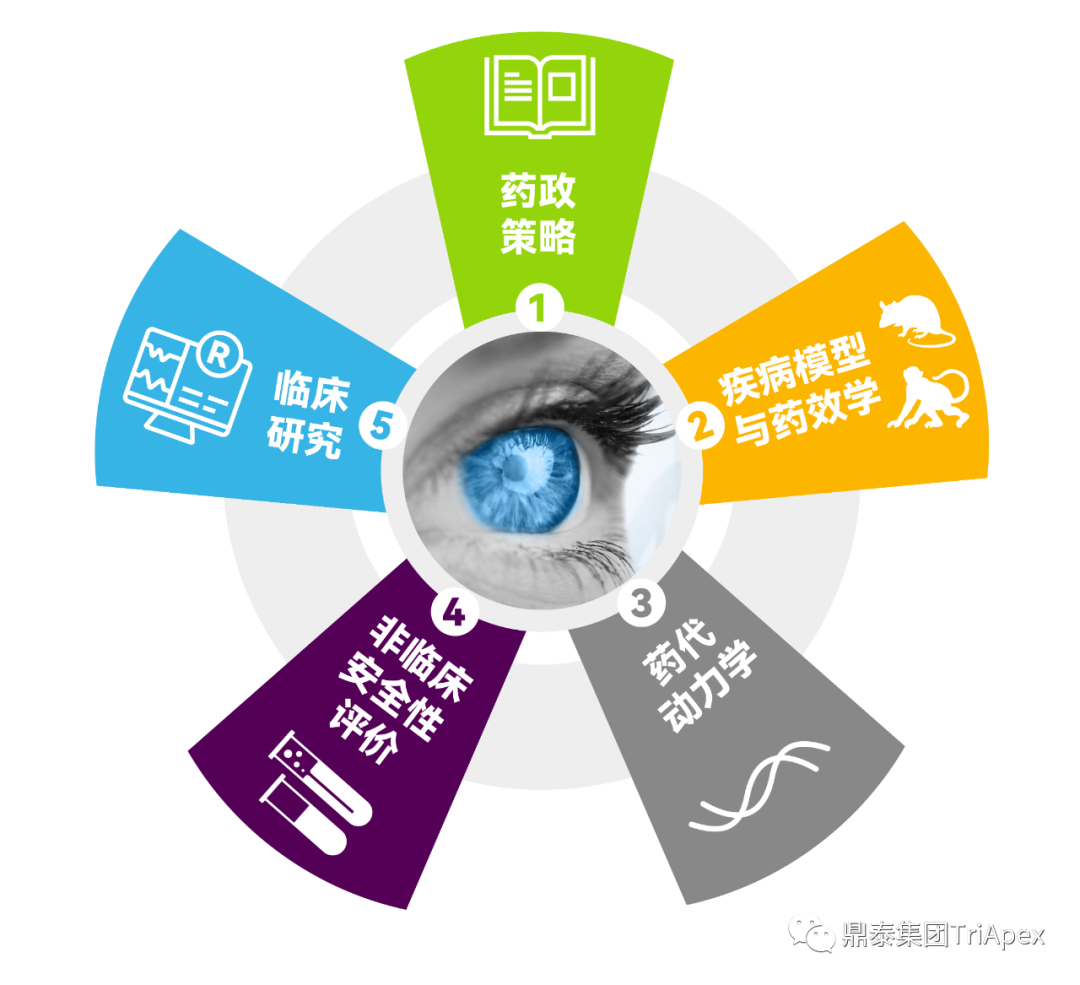
鼎泰集團眼科一體化平台 在眼科藥物或器械評價領域,鼎泰集團擁有從非臨床到臨床的一體化眼科研發(fā)賦能(néng)平台。建立了多種(zhǒng)大/小動物疾病模型,配備有行業頂尖的檢查、檢測分析設備,搭建了深耕眼科數十年的核心科學(xué)家團隊,積累了基因治療類、抗體類、小分子類等多種(zhǒng)眼科藥物的非臨床和臨床評價經(jīng)驗。 眼科領域一體化研發(fā)賦能(néng)平台 多種(zhǒng)屬綜合性眼科臨床檢查能(néng)力 眼科疾病領域一體化研發(fā)賦能(néng)平台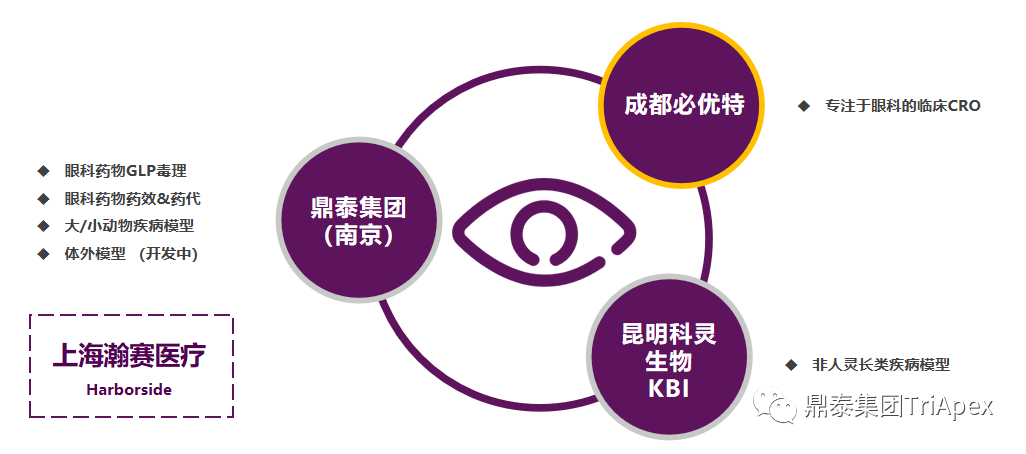

關于中因科技


































