


随着藥物研發(fā)的推進(jìn),緻癌性試驗成(chéng)爲支持部分藥物上市申請的非臨床安全性評價的重要内容之一。鼎泰團隊對(duì)藥物緻癌性試驗的必要性、緻癌性試驗的設計和數據分析以及緻癌性試驗相關的資源可及性進(jìn)行了充分的調研。本文通過(guò)回顧《ICH S系列指導原則宣講會》,及FDA對(duì)減少緻癌試驗動物指南的解讀,提出鼎泰團隊對(duì)藥物緻癌性試驗的思考和建議,力求爲國(guó)内同行、新藥研發(fā)企業和審評機構提供參考。
01
CDE關于ICH S1/S1B(R1)
藥物緻癌性試驗指導原則專家解讀
關于CDE于2022年11月17日《ICH S系列指導原則宣講會》(線上會議,國(guó)家藥品監督管理局ICH工作辦公室主辦)中,由孫濤老師對(duì)S1/S1B(R1):藥物緻癌性試驗進(jìn)行解讀,整體從S1、S1B(R1)修訂情況及S1實施思考與關注問題等方面(miàn)做了介紹。
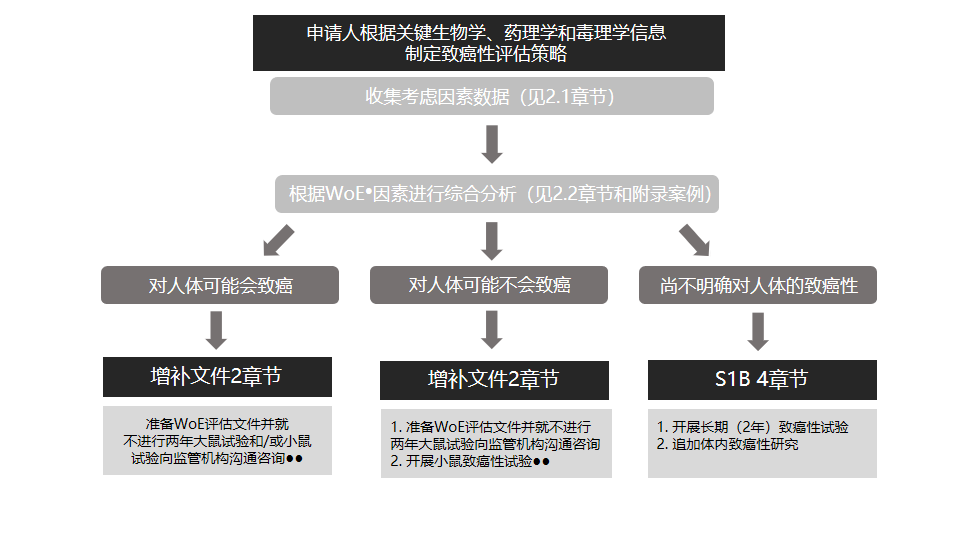
S1B(R1)内容摘要,制定緻癌性評估策略和确定2年大鼠緻癌性試驗附加價值的關鍵步驟和選項的流程圖。(來源:ICH S系列指導原則宣講會)
針對(duì)S1B(R1)提出如下相關考慮:
1、當WoE綜合評估支持提出“進(jìn)行兩(liǎng)年緻癌性試驗不會爲人體緻癌性風險評估提供更多有價值的信息”的結論時,申請人應按照當地既定的監管溝通程序,向(xiàng)相應的監管機構咨詢意見;
2、當申請人決定根據ICH S1B進(jìn)行2年大鼠試驗時,無需征求監管機構的同意:
a. 采用小鼠進(jìn)行的緻癌性試驗,無論是依據ICH S1B在标準品系小鼠中進(jìn)行的2年試驗還(hái)是在轉基因模型中進(jìn)行的短期試驗,仍然是緻癌性評估計劃中推薦的組成(chéng)部分;
b. 有些情況下,可能(néng)不适合進(jìn)行小鼠緻癌性試驗。例如:
● 當WoE評估強烈表明對(duì)人體無緻癌性風險,且數據顯示,相對(duì)于人體暴露量,在小鼠體内隻能(néng)達到亞治療劑量和無藥理學(xué)活性的藥物水平。
● 當WoE評估表明一種(zhǒng)化合物對(duì)人體可能(néng)有緻癌性。
02
FDA專家對(duì)減少緻癌試驗動物
使用最新指南的解讀
2022年2月,FDA改變過(guò)去首先發(fā)表的指南草案的做法, 直接向(xiàng)制藥工業發(fā)出終版的指南,要求業界在COVID-19期間盡量減少使用非人類靈長(cháng)類(NHP)開(kāi)展非臨床試驗,除非NHP是唯一的相關和敏感物種(zhǒng),該指南再次強調3R (reduce減少,refine優化, replace替代)。
2022年10月31日,FDA 采用CDER專家訪談的形式,請FDA/CDER/OND藥理學(xué)和毒理學(xué)副主任Timothy McGovern博士讨論了該指南對(duì)患者、藥物研發(fā)行業和公衆的意義。
2022年11月01日,FDA再次發(fā)布了S1B藥物緻癌性試驗研究S1B(R1)附錄《S1B(R1) Addendum to S1B Testing for Carcinogenicity of Pharmaceuticals》。
以下是鼎泰團隊對(duì)Tim 博士的訪談實錄概括。
Q
A
問:爲什麼(me)FDA和ICH認爲需要這(zhè)個指南?
答:在FDA CDER,我們一直在尋找如何最大程度的改善安全性評估和減少對(duì)動物試驗的,而同時保證最終使用這(zhè)些藥物的患者的安全。基于這(zhè)一點,我們與ICH以及關心藥物研發(fā)安全的個人和團體合作,對(duì)藥品緻癌性試驗的安全指南做了修訂。
提供一些背景信息,早在1995年和1997年就發(fā)表了 ICH S1指南(緻癌性研究安全指南),闡述了評估新藥緻癌風險的策略和重要性。策略要求在一種(zhǒng)齧齒動物中進(jìn)行一項長(cháng)期試驗和第二個另一種(zhǒng)齧齒動物短期或長(cháng)期補充試驗。該策略通常指爲期兩(liǎng)年的大鼠緻癌試驗和爲期兩(liǎng)年的小鼠或爲期六個月的轉基因(或基因改造)小鼠的緻癌試驗。
自1997年ICH S1指南定稿以來,尋求納入新的科學(xué)方法,改進(jìn)現行模式的努力一直都(dōu)沒(méi)有停止過(guò)。我們一直緻力于減少藥物開(kāi)發(fā)研究中所需要使用的動物。
問:您是如何制定指南的?證據權重概念是如何被引入的?
答:對(duì)緻癌性機制更深入的了解,包括幾項回顧性分析的發(fā)表,提示在某些情況下,爲期兩(liǎng)年的大鼠緻癌試驗可能(néng)不會增加對(duì)人類緻癌風險評估的價值。我們需要把患者安全、加快藥物開(kāi)發(fā)和動物福利的綜合考量,是我們修改S1B指南的初衷。在ICH框架下,FDA參加了一個專家工作組,通過(guò)回顧性數據分析和一項前瞻性研究,以确定現行的兩(liǎng)年大鼠緻癌性研究的替代方案是否仍然可以充分評估藥物的緻癌風險。我們最終确定,并在指南中描述,利用“證據權重”方法可以判斷在某些情況下無需使用兩(liǎng)年大鼠緻癌試驗,仍可以對(duì)藥物緻癌風險給與充分評估。
從科學(xué)術語字面(miàn)上講,證據權重是指調查人員對(duì)所有相關證據進(jìn)行系統評估來得出答案或者判斷。好(hǎo)比是一個天平,把每一項證據都(dōu)放在天平稱一稱,最終(所有證據彙總)提示一個臨界點,幫助我們得出(正确)結論。
我們的證據權重評估的數據中包括有關藥物的作用機制,毒理學(xué)特征,遺傳毒性的可能(néng)性,免疫調節(或變化)的證據,以及激素失調的證據等。該指南更詳細地介紹了上述因素和可推薦考慮的其他因素。
問:究竟如何在評估緻癌風險方面(miàn)應用證據權重方法呢?
答:概括來說,證據權重方法有助于我們獲得以下三個結論之一:
對(duì)證(數)據權重分析能(néng)夠提示産品可能(néng)存在緻癌風險。在我們已經(jīng)确定看預見高緻癌風險情況下,兩(liǎng)年的大鼠緻癌試驗就失去了意義。
證據權重分析能(néng)夠表明緻癌風險不大。在已經(jīng)确定了低緻癌風險情況下,爲期兩(liǎng)年的大鼠緻癌試驗也是不必要的。
如果對(duì)已有數據的綜合權重分析的結果表明緻癌風險是模棱兩(liǎng)可的,爲期兩(liǎng)年的大鼠緻癌試驗是有益的,它可以幫助确定風險的程度。
問:您認爲該指南將(jiāng)如何幫助減少用動物進(jìn)行試驗?
答:指南推薦的證據權重法剛剛開(kāi)始,可減少動物的數目還(hái)難以給出具體的數字。但指南專家小組的前瞻性研究估計,綜合證據權重法應能(néng)將(jiāng)緻癌性研究中使用大鼠的數目減少約25%左右。我還(hái)想強調,指南繼續推薦小鼠緻癌性研究仍然是緻癌性評估的組成(chéng)部分。藥物研發(fā)者有責任開(kāi)展小鼠緻癌風險的研究。因此,指南是改進(jìn)緻癌性這(zhè)一重要安全終點的評估并考慮動物替代方案方面(miàn)進(jìn)一步努力的結果。在考慮藥物安評的替代方法或者引入其他方法時,必須繼續謹慎行事(shì),始終將(jiāng)患者安全放在首位。
問:您還(hái)想從指南中強調其他問題嗎?
答:當然。該指南還(hái)介紹了基于藥物暴露量來設計rasH2-Tg小鼠模型中高劑量的方法。這(zhè)種(zhǒng)方法已用于爲期兩(liǎng)年的緻癌試驗,但尚未用于六個月的轉基因小鼠的緻癌試驗。指南給出結論是,用高于人的50倍暴露量作爲該模型高劑量選擇的标準。當然,研發(fā)者還(hái)要遵從S1指南中的其他标準。
03
結語
鼎泰集團作爲專病領域研發(fā)賦能(néng)新型CRO,緻力于從疾病機理、疾病模型到非臨床研究,再到臨床轉化的深度賦能(néng),多年以來服務于衆多企業/科研院所,積累了豐富的研究經(jīng)驗。藥物研發(fā),道(dào)阻且長(cháng),綜合國(guó)内CDE、FDA的專家意見,關于藥物緻癌性試驗的開(kāi)展,應充分評估其必要性、重要性、科學(xué)性、資源可及性,依托于上述決策樹與監管機構保持溝通。
參考資料:
[1] (CDER訪談英文原文來自美國(guó)FDA網站https://www.fda.gov/drugs/news-events-human-drugs/cder-conversation-fdas-final-guidance-carcinogenicity-testing-pharmaceuticals)
[2] S1B(R1)藥物緻癌性S1B試驗的修訂指南原文美國(guó)FDA網站FDA Guidance for Industry-S1B(R1) Addendum to S1B Testing for Carcinogenicity of Pharmaceuticals; International Council for Harmonization accessed on November 19, 2022 at https://www.fda.gov/media/152777/download)
[3] FDA Guidance for Industry-Nonclinical Considerations for Mitigating Nonhuman Primate Supply Constraints Arising from the COVID-19 Pandemic (FEBRUARY 2022, accessed on November 20, 2022 at https://www.fda.gov/regulatory-information/search-fda-guidance-documents/nonclinical-considerations-mitigating-nonhuman-primate-supply-constraints-arising-covid-19-pandemic )
[4] FDA: Advancing Alternative Methods at FDA (accessed on November 20, 2022 at https://www.fda.gov/science-research/about-science-research-fda/advancing-alternative-methods-fda)
[5] Timothy McGovern,WEIGHT OF EVIDENCE APPROACHES FOR EVALUATING CARCINOGENESIS IN DRUG DEVELOPMENT (APRIL 29, 2019) (accessed on November 20, 2022 at https://ntp.niehs.nih.gov/events/webinars-workshops/2019/coc/presentations/10mcgovern_coc_508.pdf)




































