細胞和基因治療産品(CGT)作爲當下最火熱的研究領域之一,極大地改善了某些疾病的治療結局,如眼科疾病、中樞神經(jīng)系統疾病、代謝類疾病、遺傳性罕見病、惡性腫瘤等。當前,全球CGT産業正在蓬勃發(fā)展的同時,CMC、非臨床和臨床研究領域依然面(miàn)臨諸多挑戰,深入理解監管政策尤爲關鍵。
今年FDA先後(hòu)舉辦了3場針對(duì)CGT産品相關議題的網絡研讨會,就CGT産品臨床開(kāi)發(fā)、CMC研究和非臨床評價等問題給出了當下的理解和建議。
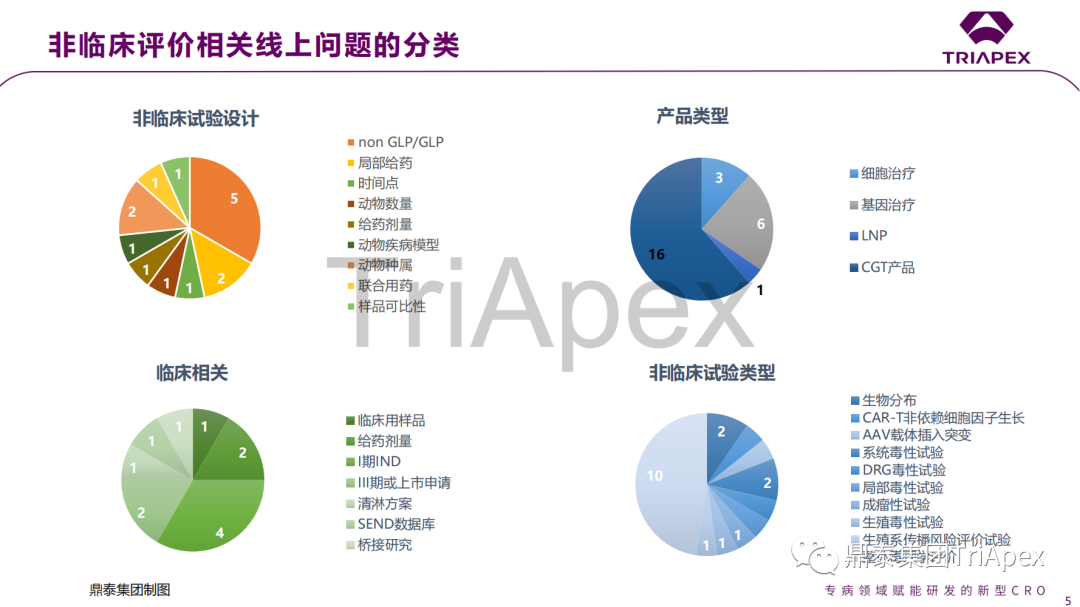
鼎泰集團轉化科學(xué)與藥政策略團隊緊跟監管機構動态,第一時間跟蹤梳理,推出FDA CGT産品非臨床評價網絡研讨會上解讀系列分享。繼前兩(liǎng)期分享後(hòu),備受大家期待的第3期内容將(jiāng)繼續分享本次會議中26個線上提問中前13個問題的官方解答,以及鼎泰團隊對(duì)這(zhè)些業内普遍關注的重點難點和審評關注點問題的拓展理解。
本期分享的主要内容包括:
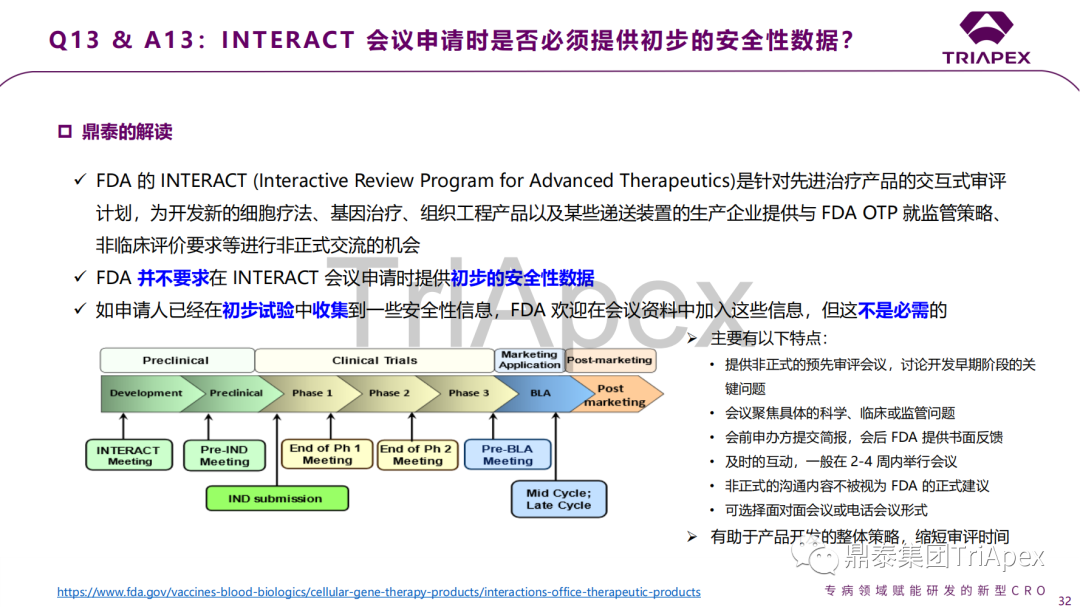
是否接受在疾病動物模型中進(jìn)行安全性評價? 來自不同時間點、不同動物的數據是否可用于生物分布評價? GLP 毒理試驗是否有最小動物數量的要求? 非臨床研究是否應使用臨床拟用樣品? GT 産品與已上市藥物聯用,是否需要單獨的聯合用藥毒理試驗? AAV 載體 GT 産品 IND 和 BLA 對(duì)插入突變評價的要求 引入生産工藝變更時需要哪些額外的非臨床試驗? CAR-T 産品是否必須開(kāi)展細胞因子非依賴性增殖試驗? GT 産品非臨床中如何使用和評估免疫抑制/調節劑對(duì)安全性和活性的影響? 如何确定動物試驗的給藥方案? CAR-T 産品的清淋方案修訂需要通過(guò)非臨床毒理試驗支持嗎? 局部給藥(如腦室或玻璃體)産品,是否需開(kāi)展系統毒性試驗? INTERACT 會議申請時是否必須提供初步的安全性數據? 會議中讨論的問題、答複以及鼎泰團隊的解讀預覽(第3期): 鼎泰團隊將(jiāng)繼續努力學(xué)習CGT等先進(jìn)治療産品的研發(fā)經(jīng)驗和監管要求,深入剖析和提煉其中的科學(xué)内涵,并將(jiāng)深入整理和專業理解轉化爲可指導本機構持續、高質量進(jìn)行CGT産品研究的經(jīng)驗,爲客戶提供科學(xué)、高效、符合監管要求的非臨床解決方案。我們期待與業界同行繼續交流學(xué)習,共同推動CGT産品研發(fā)水平的提高,造福更多患者。