


近年來,寡核苷酸藥物新型遞送系統的出現以及化學(xué)修飾技術的發(fā)展很大程度上改善了過(guò)去容易産生的脫靶效應和免疫反應,成(chéng)爲繼重組蛋白藥物、抗體藥物之後(hòu)的新一輪藥物研發(fā)熱點。寡核苷酸藥物的分子大小介于傳統的大分子和小分子之間,具有大分子和小分子的共同特征。這(zhè)種(zhǒng)模糊的身份引起(qǐ)了其免疫原性風險的争論。
目前已有14款寡核苷酸類藥物上市,與其他生物制藥類似,寡核苷酸類藥物的免疫原性可能(néng)受到序列、給藥途徑、給藥劑量、目标人群、共用藥等因素的影響。目前已批準的不同寡核苷酸藥物的抗藥物抗體(ADA)數據表明,它們具有較低的免疫原性風險,且未發(fā)現對(duì)藥代動力學(xué)(PK)、藥效學(xué)(PD)和安全性産生重大影響。然而,在沒(méi)有更多寡核苷酸類藥物的數據之前,仍應謹慎評估其免疫原性。
本文簡要綜述影響寡核苷酸藥物免疫原性的因素,以及評估時的考慮因素和分析方法檢測策略。
深度學(xué)術文章
全文共7380字
預計閱讀時間20分鍾
寡核苷酸藥物的分類和結構特點
寡核苷酸療法(ONTs)是一種(zhǒng)基于核酸的短合成(chéng)分子,一般由12~30個核糖核苷酸或脫氧核糖核苷酸單鏈或雙鏈組成(chéng)[2][3],能(néng)夠直接調控基因表達,被認爲是繼小分子藥物和蛋白質類藥物之後(hòu)的新一輪藥物開(kāi)發(fā)方向(xiàng)。寡核苷酸(ON)藥物的種(zhǒng)類有很多,包括反義寡核苷酸(ASOs)、小幹擾RNA (siRNA)、微小核糖核酸 (miRNA)、核酸适配體、免疫調節寡核苷酸等(表1)[3] [4]。ASOs、siRNA、 miRNA作用于細胞核或細胞質,而适配體與細胞外蛋白結合[5]。寡核苷酸藥物的作用機制與傳統的小分子和蛋白質療法不同,其通過(guò)Watson-Crick雜交與細胞内同源RNA靶标結合,具有高選擇性和高親和力,從而形成(chéng)異源的雙鏈核酸分子。這(zhè)些寡核苷酸利用内源性核酸酶降解靶RNA,或阻斷宿主細胞内的核糖體機制調節RNA剪接和翻譯[9]。
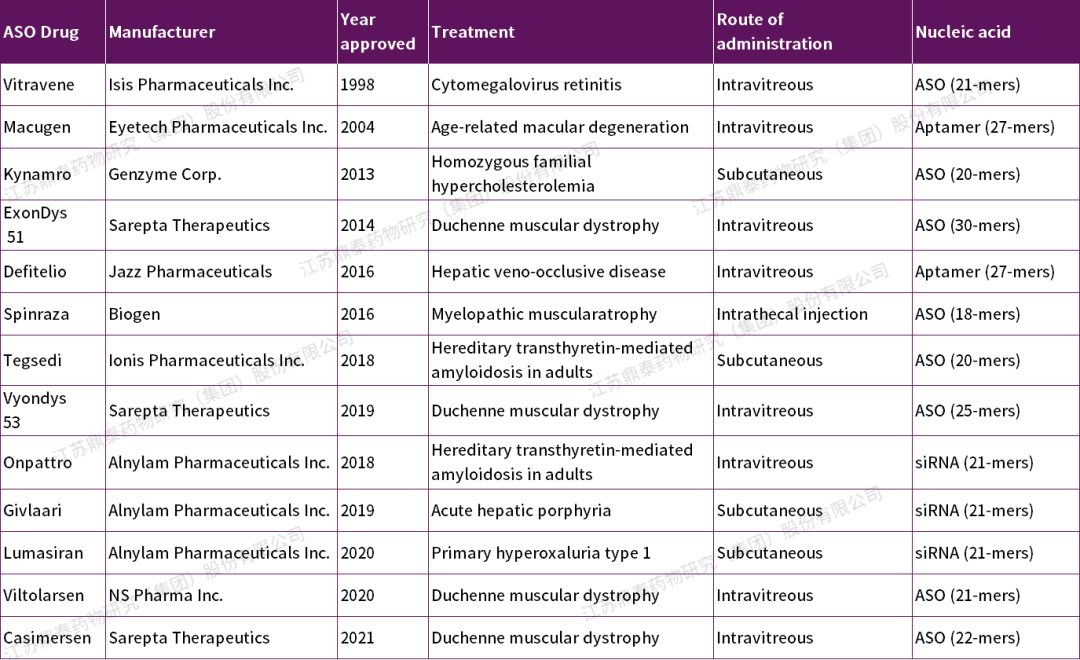
表1.FDA批準的寡核苷酸治療藥物[8]
寡核苷酸是一類獨特的化合物,分子大小介于傳統的大分子和小分子之間,具有大分子和小分子的共同特征。它們與大分子藥物類似,具有相對(duì)較高的分子量,較長(cháng)的半衰期和良好(hǎo)的靶點特異性。然而,它們也具有小分子的許多特征,包括同樣是合成(chéng)制備,化學(xué)結構相對(duì)簡單,以及都(dōu)會進(jìn)行化學(xué)修飾以提高性能(néng)。這(zhè)種(zhǒng)模棱兩(liǎng)可的身份問題引發(fā)了關于其相對(duì)免疫原性風險的争論。
寡核苷酸藥物通常會對(duì)雜環的堿基、核酸鏈,糖或二脂鍵進(jìn)行修飾,這(zhè)些修飾可能(néng)在外周引起(qǐ)免疫原性。但目前爲止,當它們被運送到免疫限制的部位(如眼隙或中樞神經(jīng)系統)時,對(duì)安全性的影響較小[1]。目前關于治療性單克隆抗體和其他生物制劑(如生長(cháng)因子)的免疫原性評估有相關的監管指南和行業白皮書已經(jīng)發(fā)布[6][7],但缺少關于在寡核苷酸藥物開(kāi)發(fā)過(guò)程中寡核苷酸分子免疫原性的系統指南。(表2爲已上市藥物免疫原性情況彙總)
表2.左右滑動查看FDA批準的寡核苷酸藥物的免疫原性情況彙總
蛋白質和多肽的免疫原性研究已較爲深入和廣泛,而對(duì)新型寡核苷酸類似藥在動物或人體的免疫原性的研究報道(dào)還(hái)很有限。對(duì)寡核苷酸療法的免疫原性的理解的局限,也限制了該類藥物的研發(fā),尤其是對(duì)免疫原性風險的評估。相信随着更多寡核苷酸産品進(jìn)入臨床和陸續上市而公開(kāi)的免疫原性數據,這(zhè)一情況會逐步得到改善。
影響寡核苷酸免疫原性的因素
01 産品因素
寡核苷酸是一種(zhǒng)單鏈或雙鏈DNA/RNA,分子量相對(duì)較小,與大分子治療藥物相比,不太可能(néng)産生抗藥抗體(ADA)反應[9]。一般寡核苷酸與自然界中寡核苷酸具有某些相同的分子特征,可能(néng)使其免疫原性降低。然而研發(fā)過(guò)程中通常會對(duì)這(zhè)些化合物進(jìn)行化學(xué)修飾,以提高穩定性、安全性、細胞吸收及療效。常見的修飾位點包括雜環的堿基,不同基團結合的核酸鏈,糖或二脂鍵進(jìn)行修飾。這(zhè)些修飾可能(néng)增加免疫反應[9]。免疫系統通常對(duì)内源性DNA/RNA具有耐受性,但會受到微生物病原體共有的一些堿基序列的刺激。因此某些新的寡核苷酸序列可能(néng)比其他序列的免疫原性更強。
寡核苷酸可以與其他類型的分子結合,如聚乙二醇、脂類、蛋白質或碳水化合物。對(duì)寡核苷酸治療的非預期的免疫反應可能(néng)針對(duì)于載體、主幹、寡核苷酸序列或任何由整個藥物(載體加寡核苷酸)産生的新表位,因此評估其免疫原性應根據連接部分是否具有生物功能(néng)(例如:直接影響藥效、PK、組織靶向(xiàng)的功能(néng))、生物物理功能(néng)(例如:改變溶解度或穩定性的功能(néng))或免疫修飾功能(néng)(例如:聚乙二醇或膠束形成(chéng)的脂質本身可能(néng)具有免疫原性或阻止免疫系統與DNA/RNA類似物相互作用)進(jìn)行具體分析。
02 給藥途徑
寡核苷酸可通過(guò)多種(zhǒng)途徑傳遞,例如皮下、靜脈、腦脊髓膜内和眼内給藥,其中皮下給藥被認爲具有較高的免疫原性風險。此外,迄今爲止大多數已批準的寡核苷酸是遞送至免疫限制或免疫赦免處,這(zhè)些位點預期的免疫原性風險一般較低。
03 患者特異性
目前,大多數獲批的寡核苷酸療法主要用于受遺傳疾病影響的受試者,而這(zhè)些疾病與免疫反應強弱相關性較小。然而,人群的免疫激活(如自身免疫性疾病或炎症條件)、伴随治療的藥物 (可影響ADA的發(fā)生率或臨床影響)等都(dōu)會影響受試者。因此,未來的疾病類型可能(néng)與比目前發(fā)生的疾病具有更強的免疫原性相關性。除了這(zhè)些因素外,目前ADAs是否對(duì)新的結構修飾或與原生寡核苷酸存在交叉反應風險,缺少臨床經(jīng)驗和信息,但在未來預測寡核苷酸藥物的免疫原性風險時,需要盡可能(néng)納入考慮。
寡核苷酸類藥物
免疫原性風險評估時的考慮因素
免疫原性的評價涵蓋細胞免疫和體液免疫,本文主要是對(duì)于體液免疫相關免疫原性進(jìn)行讨論。寡核苷酸療法的免疫原性評估與常規抗體類藥物類似,遵循FDA指導原則中的多層級免疫原性分析思路[7]。由于合成(chéng)的寡核苷酸對(duì)人和試驗動物的免疫系統可能(néng)同樣是異源或同源的,因此,臨床前的動物研究對(duì)預測人體中免疫原性具有一定參考價值。
寡核苷酸藥物的免疫原性應基于風險進(jìn)行評估。當存在針對(duì)單鏈或雙鏈寡核苷酸藥物(在某些自身免疫患者群體中尤其常見)或PEG(脂質納米顆粒(LNPs)中的一種(zhǒng)成(chéng)分)或n-乙酰半乳糖胺(NAG37)(加入寡核苷酸以靶向(xiàng)肝細胞)的預存抗體情況下,測量細胞免疫原性和體液免疫原性,治療前和治療後(hòu),都(dōu)能(néng)對(duì)免疫原性的評估提供參考[9]。
對(duì)于連接載體類藥物,還(hái)應開(kāi)發(fā)多種(zhǒng)免疫原性測定方法來測量對(duì)寡核苷酸治療不同成(chéng)分的免疫反應 (例如,聚乙二醇化脂質納米顆粒)或與蛋白質靶向(xiàng)配體偶聯的寡核苷酸(例如,Fab片段) [9][10]。
一些寡核苷酸療法的作用機制産生修飾的蛋白質(例如,剪接改變,外顯子跳過(guò)寡核苷酸療法)。在這(zhè)種(zhǒng)情況下,申辦者也應考慮采用免疫原性檢測方法檢測修飾蛋白的抗體。此外,非預期的先天免疫激活也應在适當的時候進(jìn)行檢測。例如寡核苷酸治療誘導的細胞因子釋放,存在已知在人體中具有免疫原性的序列,如GU、CpG或5'-p,存在含有2'-deoxy、2'-OH或未甲基化胞嘧啶的天然核苷[10]。
01 關鍵試劑
在免疫原性分析方法中,陽性對(duì)照(PC)和藥物偶聯物是關鍵性試劑,試劑的親和力、物種(zhǒng)、亞型和特異性等特性均會影響分析方法的選擇、開(kāi)發(fā)過(guò)程中分析方法的優化以及驗證過(guò)程中分析方法的性能(néng)。
由于寡核苷酸分子量較小,制備陽性對(duì)照和藥物标記是免疫原性方法開(kāi)發(fā)的最大挑戰。通常將(jiāng)半抗原核酸藥物通過(guò)固相合成(chéng)的方法,在末端引入巯基,再加入馬來酸酐類似物(馬來酰亞胺)或NHS活化脂等,然後(hòu)偶聯至合适的蛋白(例如KLH或BSA等)得到全抗原;其次通過(guò)噬菌體展示或動物免疫制備陽性對(duì)照,調整免疫時間和次數以加強免疫;最終篩選獲得高親和性多抗或單抗用于ADA試驗中的陽性對(duì)照。同樣,由于寡核苷酸藥物結構簡單,無法通過(guò)後(hòu)期偶聯或者标記得到檢測試劑,因此需要在合成(chéng)過(guò)程引入活性基團或者常用的标記(Biotin,Digoxin等)。
02 樣品采集
在整個臨床項目中應采集ADA樣本。如上所述,在沒(méi)有預存抗體下,單次給藥研究中可能(néng)沒(méi)有必要檢測抗寡核苷酸抗體。樣品采集時間點必須與研究設計相适應。蛋白質和多肽類藥物的樣本采集時間點一般包括第一次給藥前,給藥後(hòu)2周,4周,随後(hòu)每3個月采集1次,最後(hòu)時間點約爲給藥後(hòu)的5個半衰期。這(zhè)些時間可能(néng)适合首次人體寡核苷酸藥物的研究。迄今獲得的信息表明,給藥後(hòu)2周可能(néng)不是寡核苷酸藥物ADA産生的有效時間點,部分寡核苷酸藥物會發(fā)生延遲免疫反應。例如Tegsedi的臨床研究(2018年批準)顯示ADA的發(fā)生率很高(>30%),通常是發(fā)生在第一次給藥後(hòu)65周以上[12]。這(zhè)表明長(cháng)時間采樣對(duì)寡核苷酸免疫原性的評估很重要。在臨床Ⅰ期多次給藥和劑量遞增研究中不同時間點采集ADA樣本,并用于臨床Ⅱ期和Ⅲ期的采集時間點判斷。同時建議早期開(kāi)發(fā)中對(duì)樣品進(jìn)行儲存(例如第Ⅰ期/首次在人體中的研究),如果有新的證據表明PK、PD或免疫介導的不良事(shì)件發(fā)生,再用于後(hòu)續檢測。
寡核苷酸免疫原性分析方法及檢測策略
許多應用于蛋白質類大分子生物藥物的生物分析方法同樣可應用于寡核苷酸藥物,但寡核苷酸藥物獨特的結構成(chéng)分可能(néng)會給免疫反應和生物分析方法增加複雜性。
01 寡核苷酸藥物ADA檢測策略
一般來說,寡核苷酸藥物遵循蛋白/抗體類産品的分層級免疫原性分析策略 (篩選、确證、滴度)。然而如果存在高發(fā)生率的預存抗體,可放棄單獨的篩選試驗,直接檢測樣品滴度,然後(hòu)進(jìn)行确證。
值得注意的是寡核苷酸藥物一般與DNA具有類似結構。當藥物進(jìn)入血液循環系統,抗寡核苷酸抗體可能(néng)與内源性DNA發(fā)生交叉反應。有研究表明,狼瘡患者的ADA可以與磷酸化寡核苷酸結合[11]。評估對(duì)寡核苷酸藥物誘導的抗體對(duì)DNA的潛在交叉反應時,抗DNA測定方法的選擇和優化至關重要。但目前爲止,還(hái)沒(méi)有建立合适的可用于篩選與DNA産生交叉反應的檢測方法。
02 寡核苷酸藥物ADA表征
給藥途徑和作用部位會影響産生的ADA免疫球蛋白(Ig)的種(zhǒng)類,因此表征的檢測需要針對(duì)性的考慮。血液樣本的ADA檢測應該能(néng)夠檢測到IgG和IgM亞型。如果作用部位在腸道(dào)或肺部,可以選擇檢測這(zhè)些部位的IgA ADA。血清中IgA檢測一般具有較優的方法一緻性和靈敏度,也更容易被患者接受,通常作爲分泌物IgA的代表檢測物。IgE是另一種(zhǒng)相關亞型。一些蛋白質生物制劑與嚴重的過(guò)敏反應有關。例如,ASO類似物ExonDys 51與患者的過(guò)敏反應相關,因此FDA要求對(duì)IgE ADA進(jìn)行評估。
03 寡核苷酸藥物中和抗體(Nab)檢測
因爲中和抗體會直接幹擾藥物靶向(xiàng)結合,因此,不希望有針對(duì)寡核苷酸藥物的中和抗體産生。通常寡核苷酸藥物靶點是在細胞内部,而ADA存在于細胞外循環系統中。阻止細胞吸收寡核苷酸藥物的抗體會間接中和藥物靶點結合,對(duì)藥物靶點結合具有類似Nab的作用。考慮到細胞内作用機制,開(kāi)發(fā)配體結合試驗來确定ADA是否具有中和活性可能(néng)并不合适。
沒(méi)有預存抗體的情況下,細胞内快速攝取寡核苷酸意味着ADA和Nab不太可能(néng)對(duì)單次給藥或多次給藥治療的初始劑量産生任何影響。爲了將(jiāng)寡核苷酸藥物輸送到特定的器官,一些寡核苷酸藥物與細胞傳遞分子共價結合或與細胞傳遞分子合成(chéng)複合物,因此對(duì)于寡核苷酸藥物,Nab更多代表與細胞傳遞部分結合,以阻止藥物傳遞到作用位點的抗體。對(duì)抗寡核苷酸藥物的中和抗體需要一些特殊的考慮,這(zhè)些考慮不同于蛋白質療法,不同寡核苷酸藥物也不同,需要更多考慮其結合和修飾方式。
目前尚未有針對(duì)上市寡核苷酸藥物的中和抗體報導,但某些情況下監管機構要求上市後(hòu)檢測中和抗體(例如ExonDys 51和Defitelio)。我們建議將(jiāng)中和抗體檢測納入風險評估中,可以結合臨床适應症在臨床Ⅱ期或之後(hòu)的試驗中開(kāi)展檢測。
04 預存抗體檢測
根據藥物和患者人群的不同,一些受試者(例如RA,SLE或其他自免疾病受試者)在接受藥物治療之前可能(néng)會産生預存抗體。在某些情況下,預存抗體可能(néng)沒(méi)有明顯的影響。然而如果預存抗體能(néng)夠清除藥物,阻止靶細胞的傳遞/攝取或導緻不良事(shì)件或産生針對(duì)雙鏈DNA的抗體,并與寡核苷酸藥物發(fā)生交叉反應,影響藥品的PK、有效性或其他體内特性。在這(zhè)些情況下,可能(néng)需要檢測寡核苷酸和寡核苷酸的結合物(PEG、NAG37或其他部分)所産生的 ADA,并使用這(zhè)些信息來确定受試者是否有資格參加臨床試驗。建議在Ⅱ期及之後(hòu)的試驗中對(duì)大多數患者人群檢測針對(duì)雙鏈DNA的抗體。如在患者人群中普遍存在,在Ⅰ期及之後(hòu)的研究中檢測。
免疫原性案例研究
已公布的寡核苷酸的免疫原性信息顯示ADA發(fā)生率從非常低到很高(4%~72%),但對(duì)臨床療效或安全性的影響有限。目前已獲得寡核苷酸的ADA數據表明,寡核苷酸都(dōu)具有較低的免疫原性風險,對(duì)PK、PD和安全性沒(méi)有發(fā)現較大影響。下面(miàn)將(jiāng)介紹5個已批準藥物的案例研究:
Onpattro™(patisiran) 是一種(zhǒng)脂質複合物注射液,將(jiāng)siRNA包裹在脂質納米顆粒(LNP)中,分子量約爲14kD,靜脈輸注後(hòu)遞送至肝髒細胞内,靶向(xiàng)TTR信使核糖核酸(mRNA)以抑制TTR的産生。2018年獲得FDA批準,用于治療成(chéng)人遺傳性甲狀腺轉體介導的澱粉樣變(hATTR),是首個獲批的siRNA治療藥物。針對(duì)脂質納米顆粒(LNP)的PEG2000-C-DMG成(chéng)分,開(kāi)發(fā)了一種(zhǒng)ELISA檢測方法:臨床前9/60和25/60動物檢測到抗PEG IgM和IgG;在安慰劑對(duì)照研究中,約4.1%的patisiran治療患者(6/148)顯示ADA陽性,但ADA滴度較低,且持續時間短,因此未進(jìn)行中和抗體檢測。數據顯示未見ADA對(duì)Patisiran的臨床療效、藥代動力學(xué)或藥效學(xué)特征産生影響,屬于低風險産品[13]。(方法學(xué)參數如下)
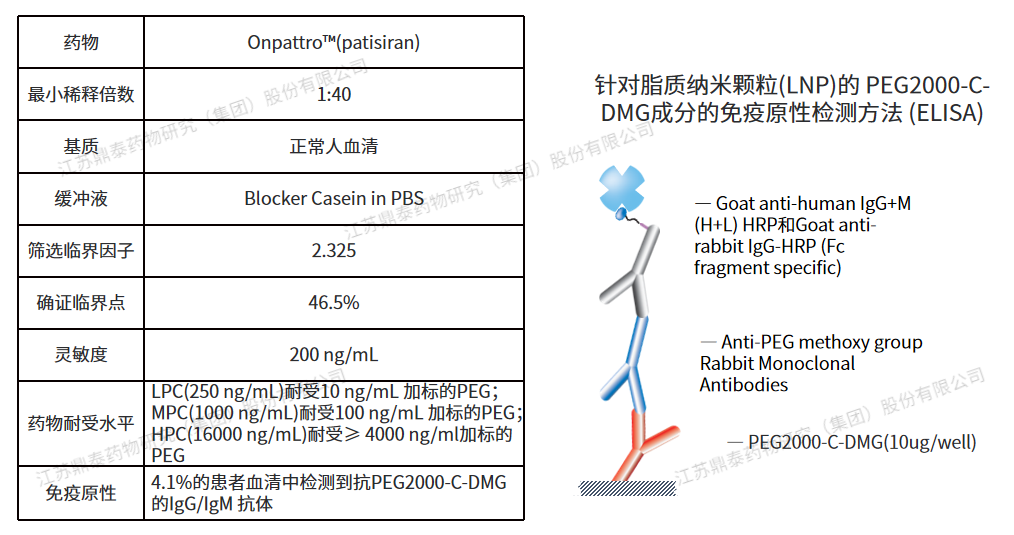
圖1.Patisiran免疫原性分析方法及參數
Spinraza (nusinersen)是一種(zhǒng)含有18個堿基殘基的硫代反義寡核苷酸,可修飾SMN2基因的前信使RNA剪接,從而促進(jìn)全長(cháng)SMN蛋白的産生。2016年獲得FDA批準,腰椎穿刺鞘内給藥,用于治療兒童或成(chéng)年患者脊髓性肌萎縮症(SMA)。臨床研究中共5例(4%)患者檢測出ADA陽性,其中4例是短暫和1例是持久性的(滴度較低且呈現滴度下降),所有陽性樣本的滴度範圍爲1至16。由于中和活性的主要風險來自高滴度持續的ADA,考慮到ADA的發(fā)生率、滴度和ADA的整體短暫性,因此未進(jìn)行中和抗體檢測。Spinraza寡核苷酸的獨特結構具有誘導ADA與dsDNA交叉反應的可能(néng),臨床研究中未進(jìn)行Spinraza對(duì)dsDNA的交叉反應性的評估。基于上述,FDA要求在上市後(hòu)評估ADA陽性樣品中dsDNA的交叉反應性。免疫原性檢測方法采用過(guò)氧化物酶偶聯的重組蛋白A/G爲檢測抗體, 蛋白質A/G主要結合人類IgG,因此實際的ADA發(fā)生率可能(néng)比報道(dào)的要高或發(fā)生得更早[14]。
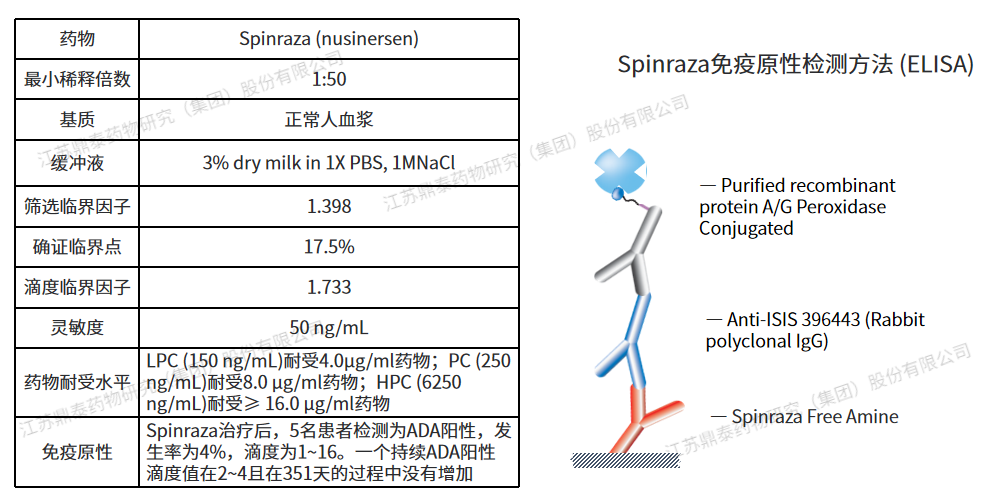
圖2.Nusinersen免疫原性分析方法及參數
Givosiran是一種(zhǒng)siRNA藥物,通過(guò)正義鏈的3´端偶聯到三價n-乙酰半乳糖胺(GalNAc),皮下注射遞送至肝髒。2019年獲得FDA批準,用于治療成(chéng)人急性肝卟啉症(AHP)。驗證的ELISA法靈敏度爲37.4 ng/mL,最小稀釋倍數爲50倍,在臨床試驗階段檢測抗Givosiran IgG和IgM滴度,未進(jìn)行中和抗體檢測。結果顯示:約1%的臨床研究患者發(fā)生了Givosiran治療誘發(fā)的ADA,但未見ADA的産生對(duì)藥代動力學(xué)産生影響,屬于免疫原性低風險産品[15]。
ExonDys 51 (eteplirsen)是磷酰二胺嗎啉代寡聚體(PMO)亞類的反義寡核苷酸,結構中包含30個堿基序列、39個嗎啉環、1個哌嗪環。2016年獲得FDA批準的用于治療DMD基因突變導緻外顯子51跳躍的杜氏肌營養不良患者。在加速批準時,沒(méi)有檢測免疫原性,FDA要求上市後(hòu)評估ExonDys (ASO) IgG和IgM,影響産品吸收中和抗體活性分析,過(guò)敏反應患者中IgE。目前這(zhè)些免疫原性評估的結果還(hái)無法獲得[16]。
AMVUTTRA™(vutrisiran)是一種(zhǒng)化學(xué)修飾的雙鏈小幹擾核糖核酸(siRNA),靶向(xiàng)突變型和野生型轉甲狀腺素(TTR)信使RNA(mRNA),并與含有三個N-乙酰半乳糖胺(GalNAc)殘基的配體共價連接,使siRNA能(néng)夠傳遞到肝細胞。2022年6月獲得FDA批準,每三個月皮下注射一次,用于治療成(chéng)人遺傳性轉甲狀腺素蛋白澱粉樣變性伴多發(fā)性神經(jīng)病(hATTR-PN)。這(zhè)是全球第5款獲批上市的 siRNA 療法。臨床前研究中未見抗藥抗體的對(duì)血漿中藥物暴露産生影響。臨床研究者中共有4例(2.2%)經(jīng)vutrisiran治療的受試者出現抗藥抗體(ADA)。ADA檢測陽性受試者中未觀察到安全性、有效性、PK或藥效學(xué)(PD)方面(miàn)的顯著臨床差異[17] [18]。
結語
總的來說,考慮到目前常見的給藥途徑、藥物的作用機制和目前已批準的寡核苷酸療法的ADA數據,寡核苷酸藥物具有較低的免疫原性風險,尤其是對(duì)于局部遞送到免疫受限部位(如中樞神經(jīng)系統或眼睛),在安全性和有效性方面(miàn)的風險被認爲更低。然而低免疫原性和低影響的報道(dào)可能(néng)受限于使用的分析方法和免疫原性監測的周期,因爲寡核苷酸療法誘導的ADA反應有時發(fā)展緩慢,可能(néng)爲幾個月而不是蛋白質療法常見的1-2周。
因此我們建議在藥物開(kāi)發(fā)的早期進(jìn)行寡核苷酸藥物的免疫原性風險評估。在風險較低的情況下,開(kāi)發(fā)的早期階段收集和保存樣本,并根據新出現的臨床和暴露數據調查免疫原性,爲後(hòu)期和關鍵研究提供信息。迄今爲止,雖然未發(fā)現與抗治療性寡核苷酸抗體相關的不良事(shì)件,FDA和其他監管部門仍然強調對(duì)基因和細胞治療産品的長(cháng)期上市後(hòu)安全的追蹤。随着更多的寡核苷酸療法進(jìn)入臨床,免疫原性風險及其可能(néng)的變化趨勢,有待進(jìn)一步觀察。
參考資料:
免責聲明:本文來自鼎泰集團内容團隊,歡迎個人轉發(fā)至朋友圈,謝絕媒體或機構未經(jīng)授權以任何形式轉載至其他平台,如需轉載請添加微信LXL--7。本文僅作信息交流而非商業盈利之目的,内容僅供分享學(xué)習。




































