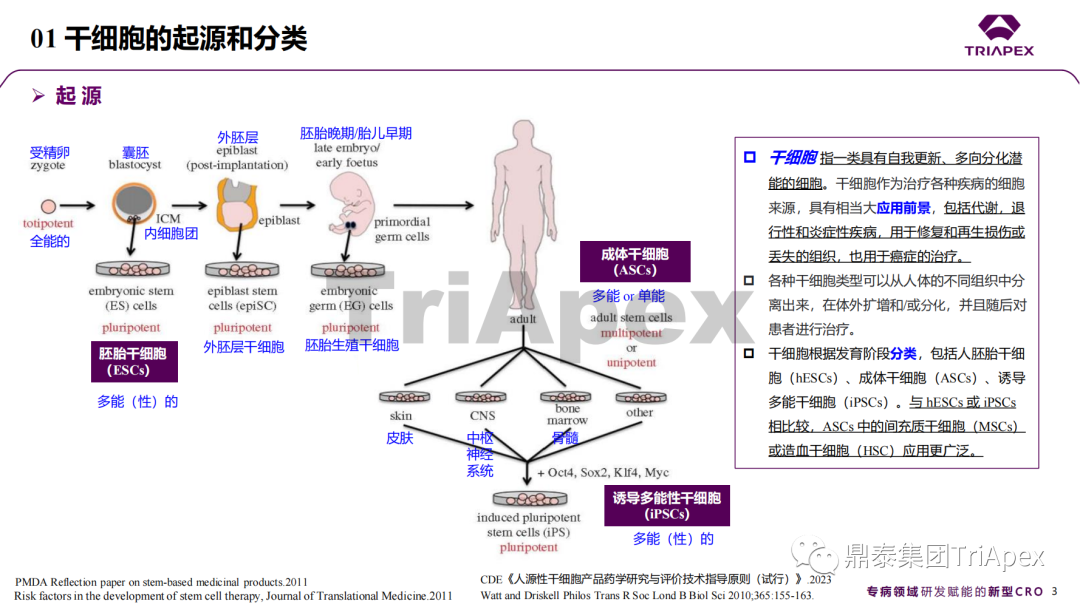
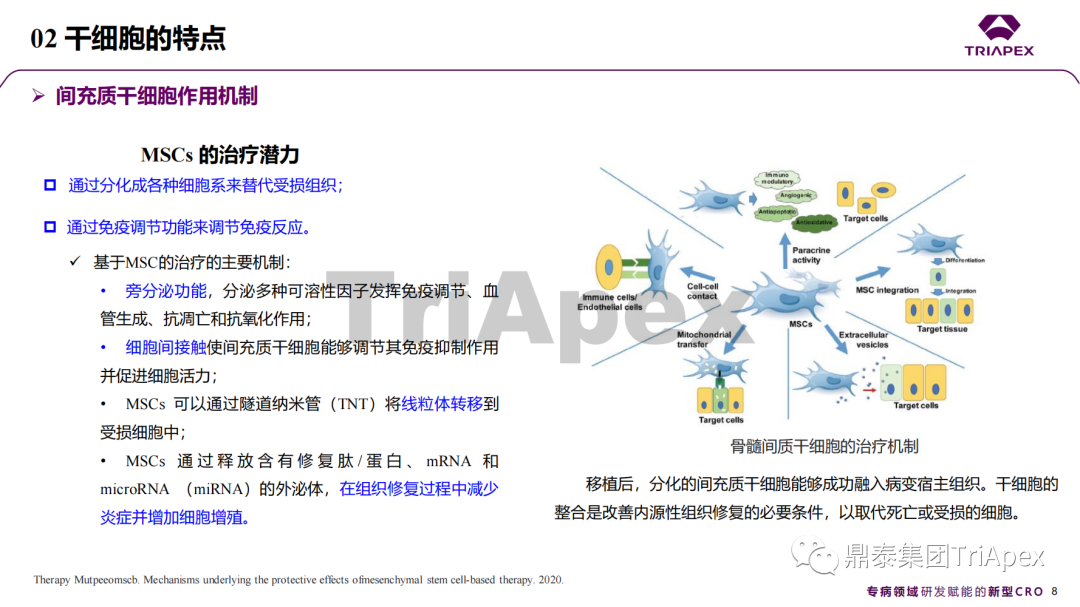
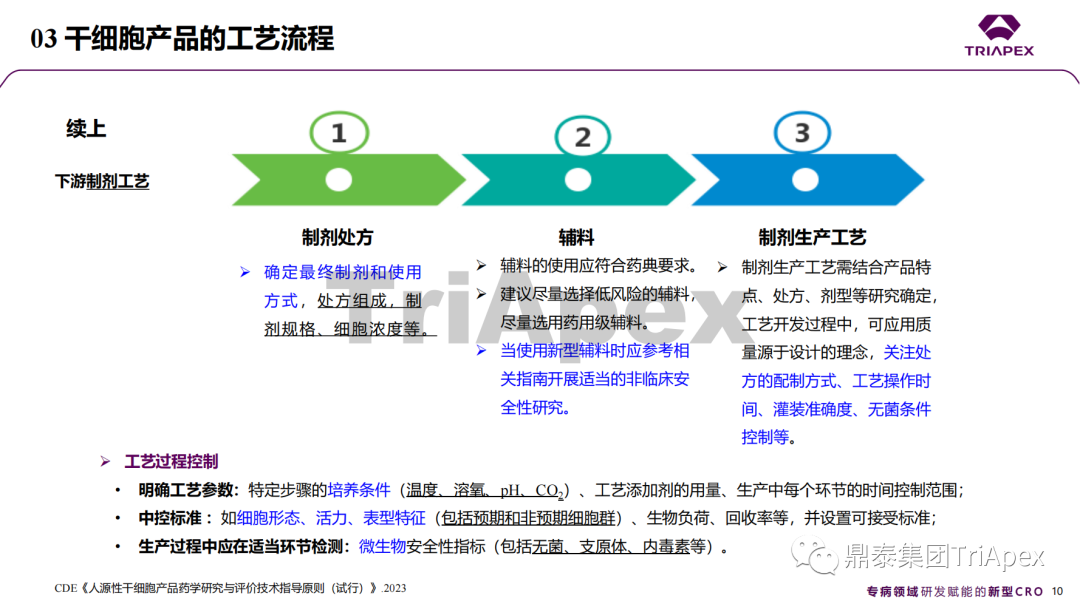
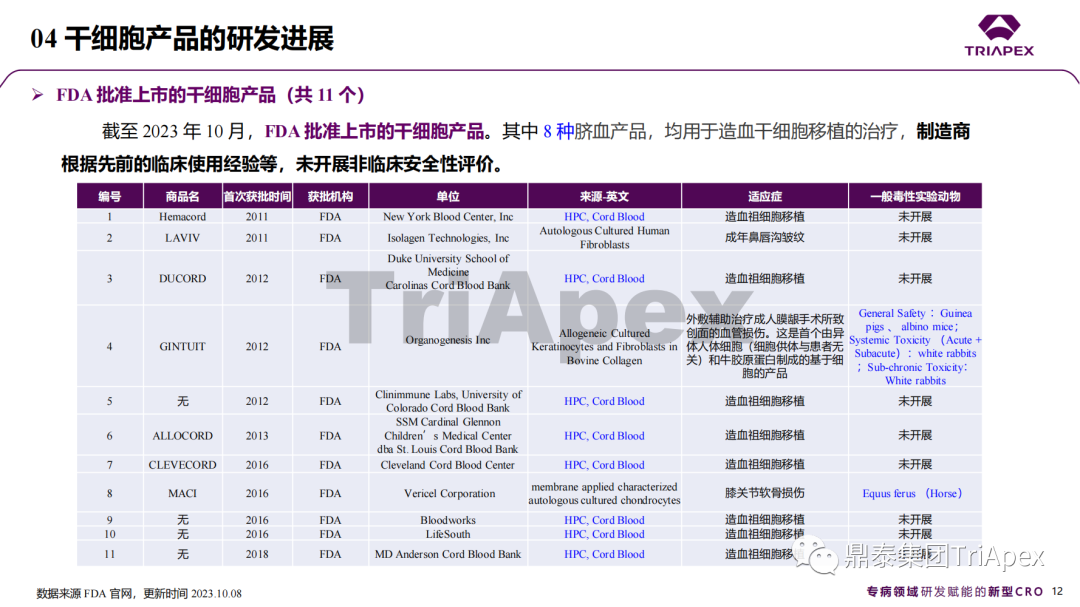
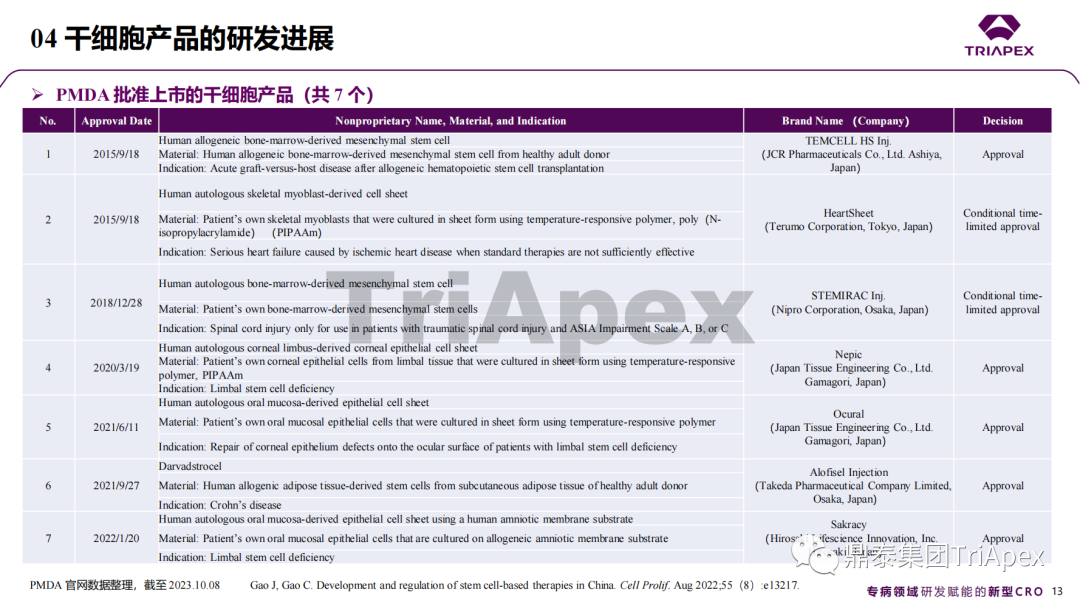
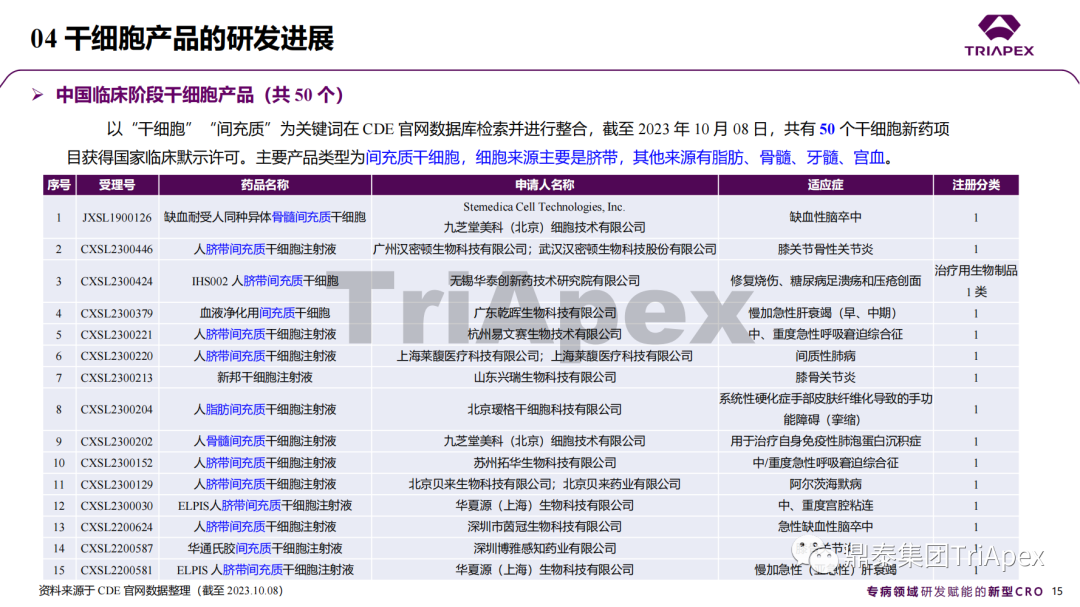
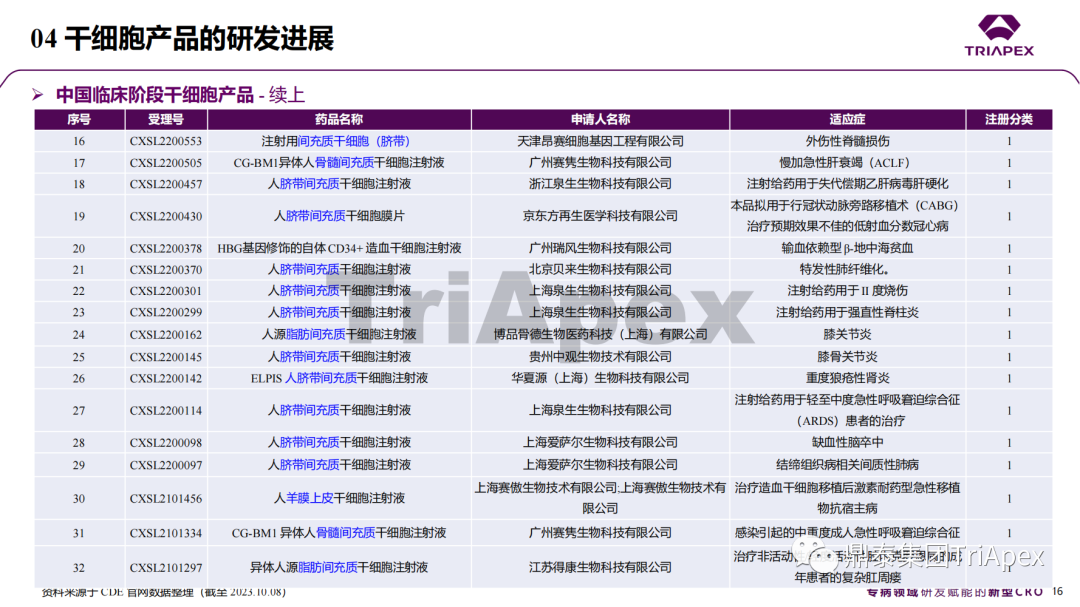
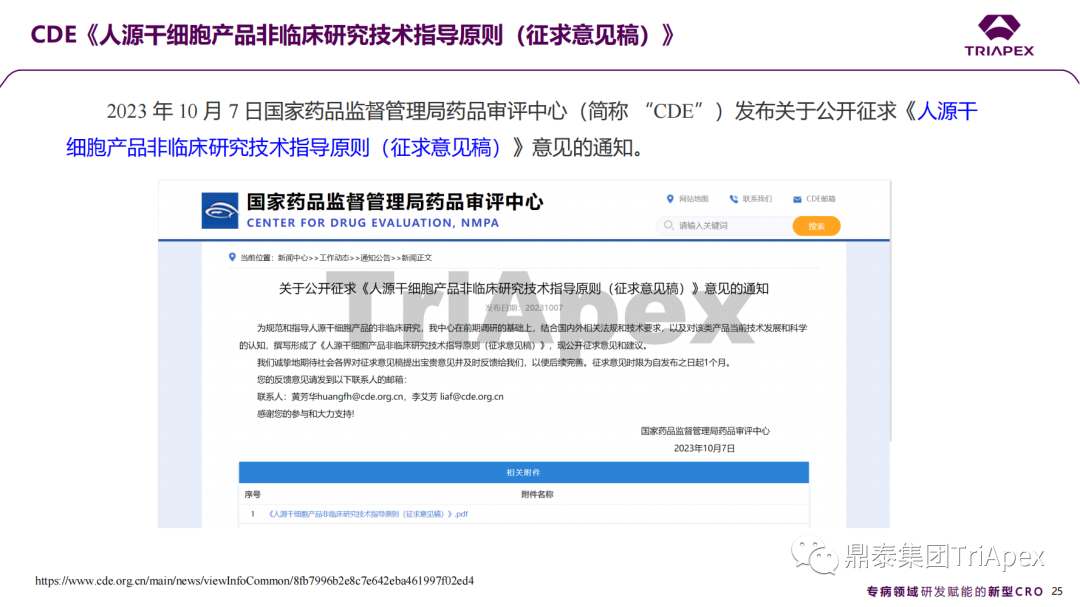
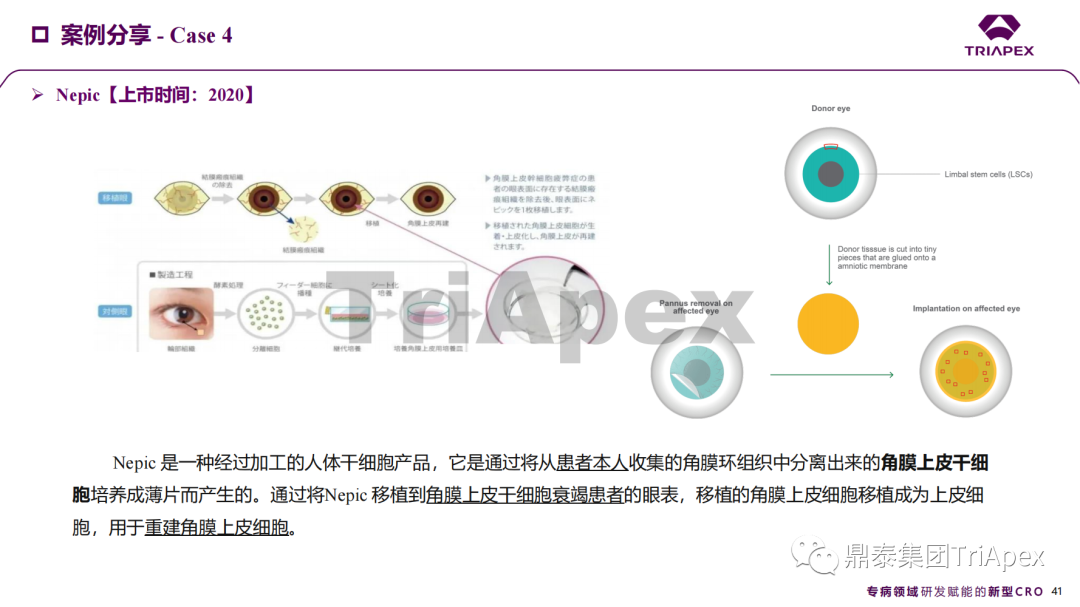
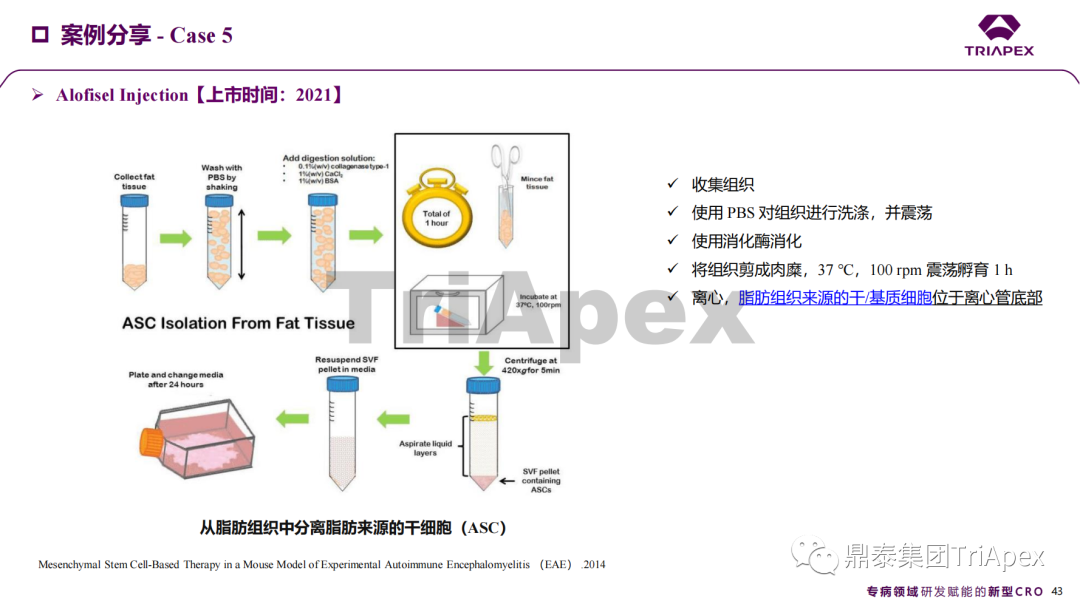
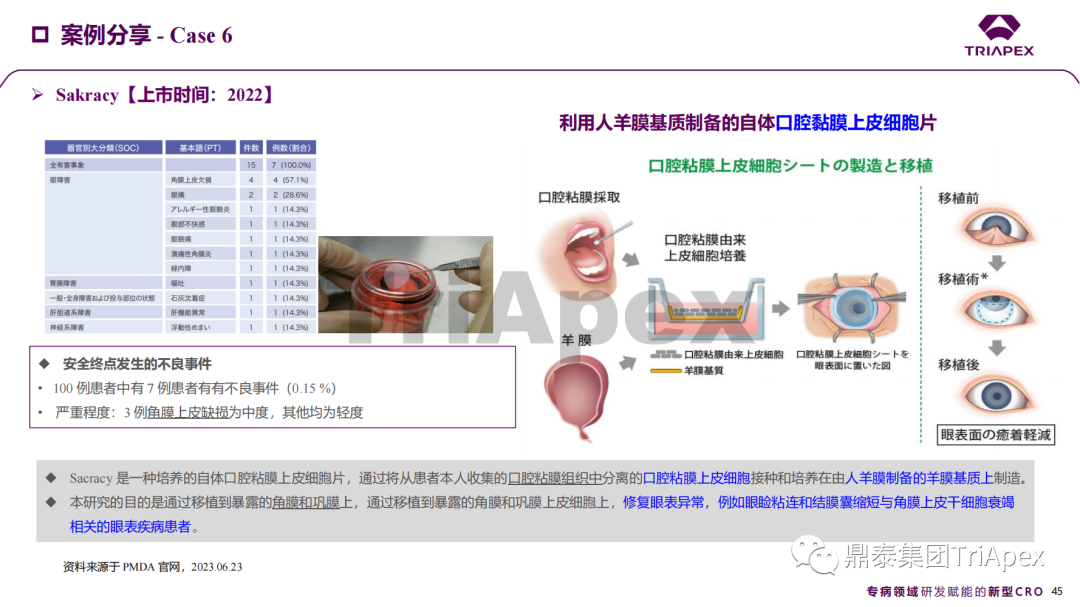
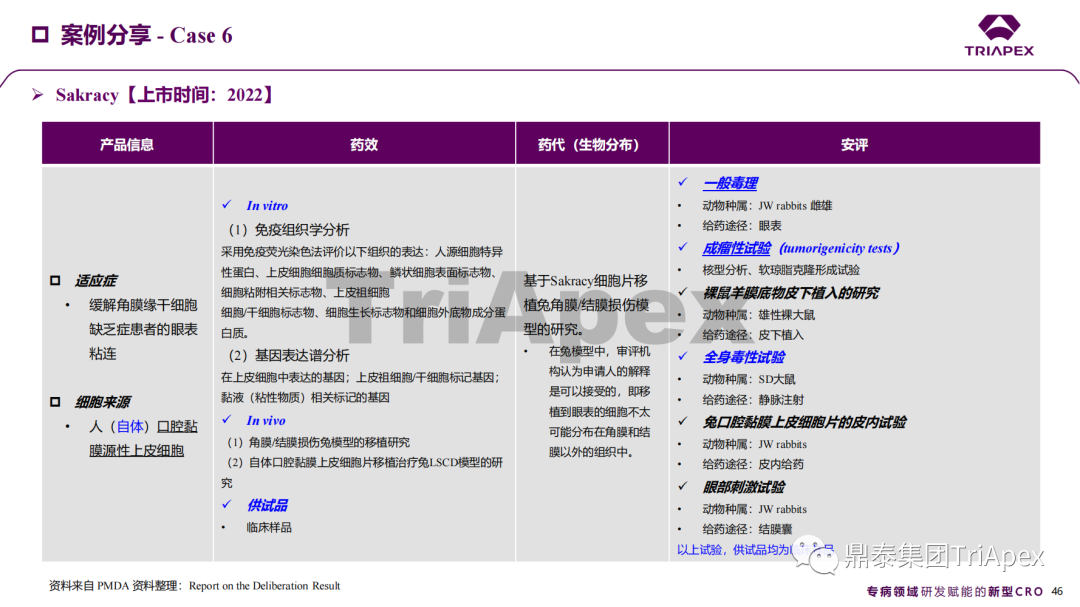
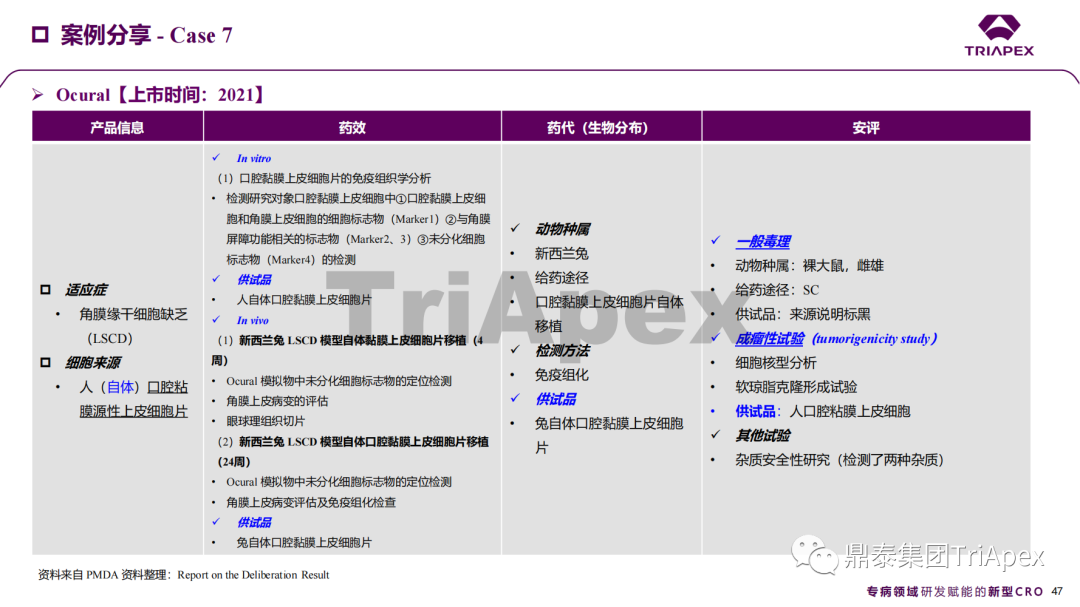
近年來,幹細胞療法已逐步成(chéng)爲生物醫學(xué)領域的一大熱點,爲許多難治性疾病提供了新的治療方案。2023年10月7日,國(guó)家藥品監督管理局藥品審評中心(CDE)發(fā)布了關于公開(kāi)征求《人源幹細胞産品非臨床研究技術指導原則(征求意見稿)》意見的通知,爲國(guó)内人源幹細胞産品的研發(fā)帶來了方向(xiàng)和指引。
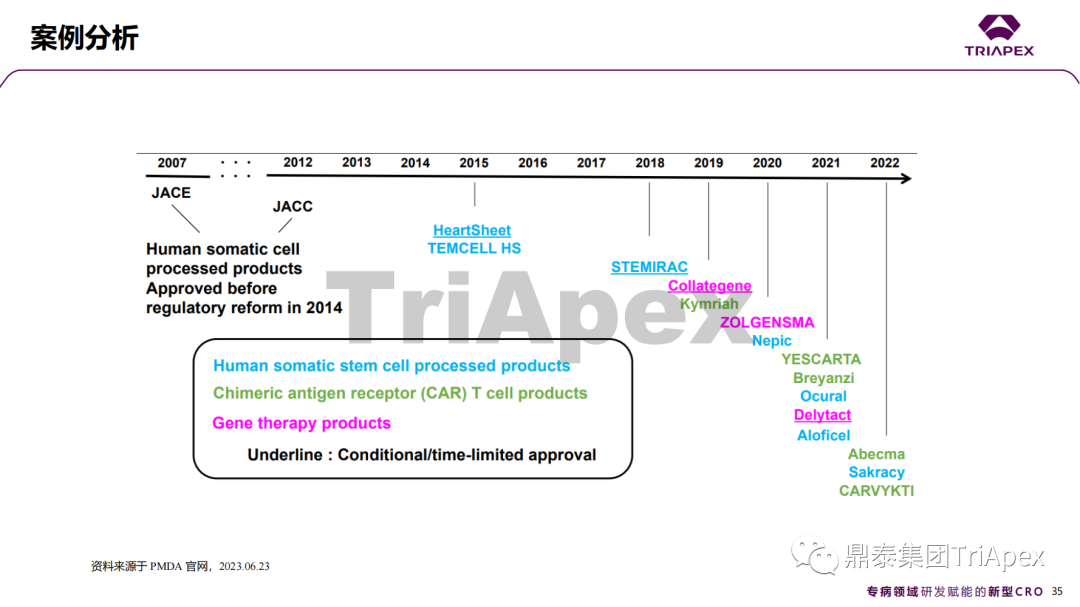
CDE官網截圖 以此爲契機,鼎泰集團非臨床團隊迅速組織進(jìn)行了一次認真、系統的學(xué)習和理解、領會。本次學(xué)術活動從幹細胞産品的背景信息和研究進(jìn)展開(kāi)始,并結合國(guó)内外8個相關指導原則和7個已獲批上市的産品的案例對(duì)幹細胞産品非臨床研究的重要關注點和主要研究内容進(jìn)行了系統梳理。 通過(guò)本次活動,鼎泰團隊對(duì)國(guó)内外監管要求、非臨床研究策略和具體實施過(guò)程等有了深入和系統的理解,也能(néng)更加規範地指導本機構開(kāi)展人源幹細胞産品的非臨床研究。下文將(jiāng)本次學(xué)術活動的主要技術内容進(jìn)行分享,也期待廣大業内同行一起(qǐ)交流、探讨,緊跟監管步伐,共同推動國(guó)内人源幹細胞産品的開(kāi)發(fā)。 學(xué)術活動現場照片