上一期,鼎泰團隊對(duì)FDA CGT産品非臨床評價網絡研讨會上讨論的前13個會前征集問題及答複意見(共27個)進(jìn)行了梳理和分享,涉及的内容包括:動物種(zhǒng)屬數量、目标患者群體與種(zhǒng)屬選擇、無合适疾病動物模型時的情形、人體幹細胞産品的非臨床研究等業内普遍關注的研發(fā)難點和審評關注點,并進(jìn)一步拓展延伸了鼎泰集團對(duì)上述問題的專業理解(點擊閱讀:FDA CGT産品非臨床評價網絡研讨會複盤與鼎泰理解第1期),收到了很多業内同行的認可和鼓舞。
恰逢FDA公布了本次會議的視頻鏈接,本期第一時間進(jìn)行線上分享(文末點擊“閱讀原文”跳轉至原視頻)。
應廣大同行的建議,鼎泰集團轉化科學(xué)與藥政策略團隊繼續就後(hòu)14個會前征集問題及答複意見進(jìn)行梳理和解讀,以便更好(hǎo)地指導本研究機構當前的工作,并爲更多的鼎泰客戶提供科學(xué)、高效、滿足監管要求的非臨床研究;同時,也期待與更多從事(shì)CGT産品開(kāi)發(fā)的同行進(jìn)行積極的交流、探讨、共同提高!
本期分享主要涉及的内容包括:
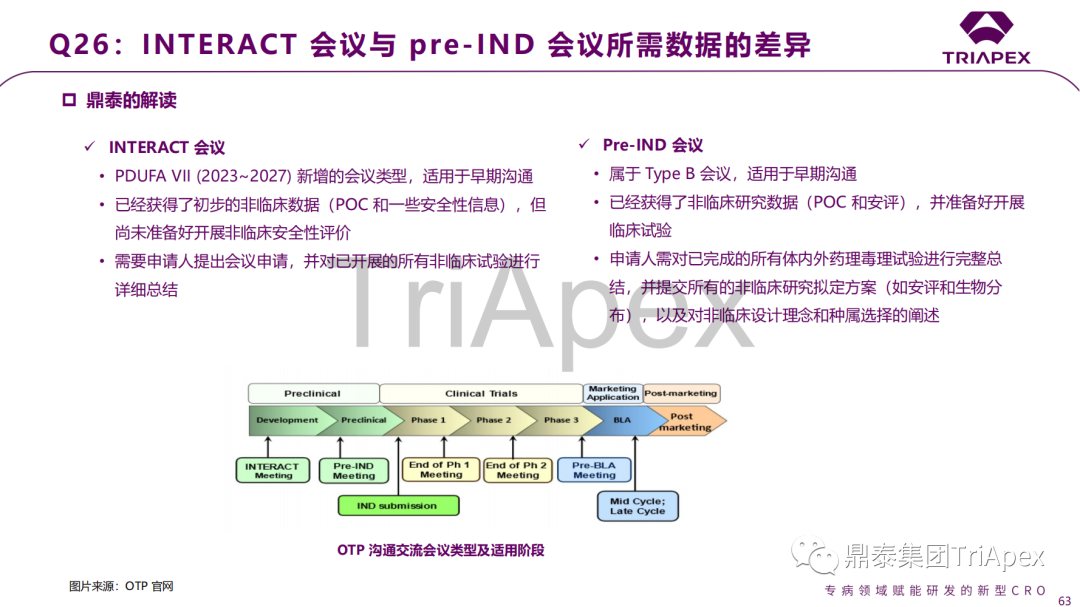
非臨床研究中考察脫落情況的必要性 文獻數據+PBPK 建模信息是否足以豁免生物分布試驗 整合性藥效/毒理試驗設計 個性化藥物非臨床毒理學(xué)研究的要求 細胞治療産品體外和體内成(chéng)瘤性試驗 基因編輯産品的生殖系傳播風險評估 支持 IND 和 BLA 的單次給藥毒性試驗周期 預存體液免疫對(duì) GT 産品有效性的影響 從動物實驗向(xiàng)臨床的外推 非臨床試驗中影響 IND 申報的缺陷 相同平台 GT 産品已有 GLP 毒理數據的借用 Type D 會議與 INTERACT 和 pre-IND 的順序 INTERACT 會議與 pre-IND 會議所需數據的差異 含組織病理檢查的整合性藥效/毒理試驗是否需要 SEND? 會議中讨論的問題、答複以及鼎泰團隊的解讀預覽(第2期):



















對(duì)于細胞基因治療産品的開(kāi)發(fā),如何開(kāi)展非臨床研究至關重要。在了解不同CGT産品的特點和風險的基礎上,以服務臨床開(kāi)發(fā)爲導向(xiàng)來指導非臨床研究的安全性研究策略具有重要指導意義。鼎泰集團作爲一體化研發(fā)賦能(néng)的新型CRO,非臨床研究作爲其中重要的業務布局,在包括CGT産品在内的藥物開(kāi)發(fā)上具有豐富的項目經(jīng)驗。本次關于FDA CGT産品非臨床評價的深入整理與解讀分享,期待能(néng)與諸位業内同行共同學(xué)習、探讨,共同推進(jìn)CGT産品臨床轉化。