


反義寡核苷酸類(ASO)藥物通過(guò)Watson-Crick堿基配對(duì)規則與靶向(xiàng)的mRNA結合,可以治療傳統小分子或基于蛋白質策略難以實現的疾病。自第一個ASO藥物Fomivirsen于1998年獲批以來,FDA已經(jīng)批準了10款ASO藥物用于多種(zhǒng)罕見病的治療,并且還(hái)有更多的藥物處于各個研發(fā)階段。但在ASO藥物研發(fā)的早期階段,臨床前研究側重于改善藥物的遞送效率并評估其在靶組織中的分布和療效,很少涉及對(duì)藥物安全性特征的綜合評估。
本文彙總了已上市ASO藥物的臨床不良反應,并通過(guò)對(duì)上述藥物非臨床研究結果的回顧,分析了非臨床研究在指導ASO藥物臨床開(kāi)發(fā)中的價值和局限性,探索非臨床安全性評估中主要的考量因素,以期爲後(hòu)續ASO新藥的開(kāi)發(fā)與評估提供一定的參考。
已上市ASO藥物臨床不良反應彙總
根據分子作用機制,已上市10種(zhǒng)ASO藥物可以分爲5類:
① RNase H-介導的mRNA 降解, 包括靶向(xiàng)CMV IE2 mRNA的 Fomivirsen、靶向(xiàng)Apo B mRNA Mipomersen和靶向(xiàng)轉甲狀腺素 (TTR) mRNA 的Inotersen;
② 誘導外顯子跳躍藥物,适應症均爲肌營養不良,包括針對(duì)外顯子51 跳躍的Eteplirsen、針對(duì)外顯子53跳躍的Golodirsen、Viltolarsen和針對(duì)外顯子45 跳躍的Casimersen;
③ 靶向(xiàng)運動神經(jīng)元2 (SMN2)的pre-mRNA外顯子修複的Nusinersen;
④ 通過(guò)與血管内皮生長(cháng)因子(VEGF)受體相互作用的适配體藥物Pegaptanib;
⑤ 針對(duì)多靶點的Defibrotide,通過(guò)與腺苷受體A1和A2結合,降低了纖溶酶原激活物抑制劑1(PAI-1)水平,具有抗血栓及纖溶活性。
ASO藥物的作用機制和适應症各不相同,在臨床試驗中的不良反應也多樣。一些不良反應屬于ASO藥物常見反應,如注射部位反應,頭痛和發(fā)熱等,這(zhè)可能(néng)是由ASO藥物的免疫反應所介導。Golodirsen、Viltolarsen和Casimersen可導緻呼吸道(dào)感染引發(fā)咳嗽;而Defibrotide、Eteplirsen和Golodirsen存在ASO藥物常見的胃腸道(dào)不良反應,如惡心和嘔吐。常見反應如頭痛、發(fā)燒、流感樣症狀、腹痛、惡心和疲勞,可以通過(guò)非處方藥治療。
已批準的ASO藥物中,由于每種(zhǒng)藥物的吸收、分布、代謝和排洩(ADEM) 特性不同,寡核苷酸序列和化學(xué)修飾的不同,給藥途徑以及靶器官的不同,因此某些ASO藥物具有獨特的不良反應,如Fomivirsen和Pegaptanib可導緻眼部炎症。
此外,需要重點關注的是FDA列出的黑框警告,如Mipomersen和Inotersen存在肝損傷;Pegaptanib、Defibrotide和Golodirsen出現超敏反應;Inotersen和Nusinersen可導緻血小闆減少;Golodirsen、Viltolarsen 、Casimersen和Nusinersen等大多數藥物則存在明顯的腎毒性。

表1. 已上市ASO藥物的臨床不良反應彙總
已上市ASO藥物非臨床研究毒性彙總
已上市ASO藥物均在非臨床研究階段使用齧齒類動物(大鼠或小鼠)和非齧齒類動物(犬或猴)進(jìn)行了不同周期的重複給藥試驗,同時也有部分藥物就行了單次給藥毒性試驗。在給藥方式上,除了局部給藥的Fomivirsen、Pegaptanib和Nusinersen還(hái)存在額外的靜脈輸注外,其餘藥物在非臨床階段的給藥方式均同臨床給藥。在非臨床研究中常見的毒性反應是給藥局部毒性和高暴露器官毒性反應,如表2所示。

表2. 已上市ASO藥物的非臨床研究毒性彙總
給藥局部毒性反應常表現爲眼内炎症、注射部位腫脹等,如Fomivirsen、Defibrotide和Golodirsen;最常見的系統性毒性表現爲肝髒損傷和腎小管上皮細胞嗜堿性顆粒聚集和空泡化,如Mipomersen、Inotersen和Eteplirsen。此外,Viltolarsen和Casimersen等腎小管的改變和臨床FDA列出的黑框警告是是密切相關的。其他毒性試驗中,除Fomivirsen可能(néng)導緻染色體結構畸變外,其他藥物均沒(méi)有遺傳毒性;在緻癌性研究中,大部分藥物并未開(kāi)展,在已開(kāi)展緻癌性試驗中,Mipomersen可導緻肝細胞腺瘤和皮膚/皮下纖維肉瘤的發(fā)生率增加。
非臨床研究中的毒性特征與
臨床不良反應的相關性分析
藥物的非臨床研究對(duì)于臨床不良反應的預測至關重要,相關文獻表明:同時使用齧齒類和非齧齒類動物的非臨床研究對(duì)預測人體不良反應的陽性一緻性爲71%,單獨使用非齧齒類和齧齒類的預測率分别爲63%和43%[1],表明動物試驗可反應大部分臨床不良反應。
在已上市ASO藥物中,大多數非臨床毒性和臨床不良反應是一緻的。
如玻璃體注射(IVT)的兩(liǎng)款藥物Fomivirsen和Pegaptanib可導緻眼部炎症;Mipomersen和Inotersen因肝損傷被列入黑框警告;Inotersen存在明顯的血小闆減少;Defibrotide在非臨床試驗中出現全身炎症反應增加,而在臨床階段則因過(guò)敏反應被列入黑框警告;Golodirsen、Viltolarsen 和Casimersen存在明顯的腎毒性;Viltolarsen出現注射部位反應。
但也存在部分非臨床毒性并未在臨床中觀察到的,如Mipomersen并觀察到血小闆減少;Defibrotide和Casimersen沒(méi)有注射部位反應;由于人不同于試驗動物,無法确定Nusinersen用藥後(hòu)是否導緻神經(jīng)元和膠質細胞壞死。
此外,部分反應因人和動物的差異以及檢測方法的局限,無法在非臨床試驗中獲得,如Fomivirsen和Pegaptanib可導緻視力下降;Inotersen、Eteplirsen和Golodirsen未在動物中發(fā)現過(guò)敏反應;藥物導緻的各類疼痛、疲勞和惡心也無法在動物試驗中檢測到。
通過(guò)分析非臨床研究和臨床試驗的不良反應,ASO藥物的非臨床毒性主要表現爲免疫刺激反應,血小闆減少以及高暴露器官(肝腎)的毒性[2][3]。由于ASO藥物的核酸特性,在設計過(guò)程中,需通過(guò)化學(xué)修飾改善其穩定性,但化學(xué)修飾一定程度上可引起(qǐ)機體的免疫刺激反應,并且修飾後(hòu)的硫代磷酸酯(PS)主鏈上的高親和力化學(xué)物質可能(néng)會導緻肝毒性或腎毒性。ASO藥物一般外周達峰時間短,主要還(hái)是分布于相關靶組織及給藥局部,易造成(chéng)部分組織的藥物高暴露。
ASO藥物非臨床安全性評估主要考量因素
結合ASO藥物特性和不良反應表現,ASO藥物的安全性評估考量因素可分爲3類:(1)雜交和序列相關性因素;(2)雜交無關序列相關性因素;(3)雜交與序列無關因素。
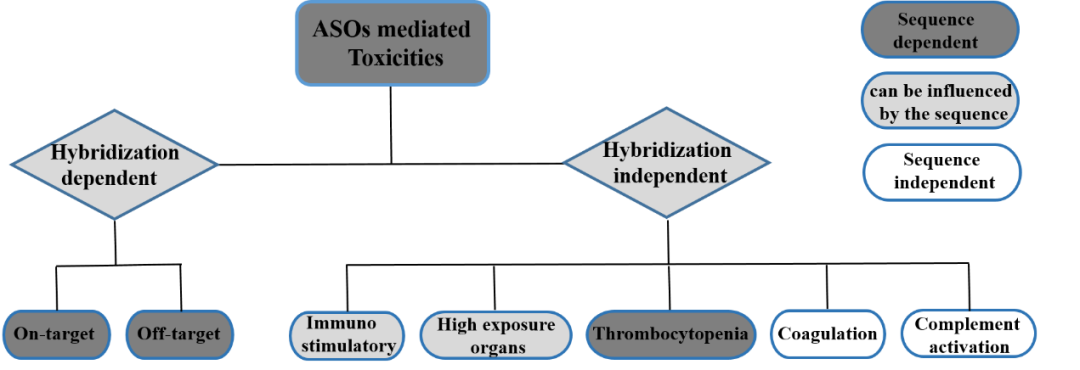
圖1. ASO藥物介導的毒性示意圖
01 雜交和序列相關因素
雜交和序列均相關的毒性主要包括On-target靶向(xiàng)毒性和Off-target脫靶毒性。
靶向(xiàng)毒性是由ASO藥物的藥理作用放大而引起(qǐ),可能(néng)導緻過(guò)強的藥理作用或在非預期組織中出現藥物的不良反應。脫靶毒性則是ASO藥物通過(guò)堿基配對(duì)原則作用于其他轉錄本而非預期轉錄本而引起(qǐ)的毒性[4][5]。
雜交和序列相關因素在藥物設計時應被優先考慮,包括物種(zhǒng)差異、化學(xué)修飾和生産性攝取等。脫靶毒性的評估可通過(guò)對(duì)靶向(xiàng)mRNA前體的整個轉錄組進(jìn)行電子篩選以确定脫靶雜交的候選基因。靶向(xiàng)毒性的評估主要依賴于收集有關靶向(xiàng)的生物功能(néng)、組織表達模式的可用信息,以及來自同一靶向(xiàng)的其他藥物的公開(kāi)信息。
理想情況下,體外評估應在生物學(xué)相關的細胞系中進(jìn)行,優先在人原代細胞或MPS中進(jìn)行。體内評估需要在與候選藥物具有物種(zhǒng)交叉反應性的動物中進(jìn)行。
02 雜交無關,序列相關因素
免疫刺激反應通常是ASO藥物的主要反應之一,其毒性在很大程度上取決于核苷酸序列設計和化學(xué)修飾。ASO藥物通過(guò)與TLR等模式識别受體(PRR)結合來激活先天免疫系統[6],在臨床上導緻注射部位反應、流感樣症狀和血小闆減少[2],如圖2所示。
免疫刺激效應的評估可在體外用分離的外周血單核細胞或全血測定預測細胞因子釋放來評估。此外,有3款藥物因臨床出現瘙癢和荨麻疹等過(guò)敏反應而被FDA列入黑框警告,但在非臨床研究中并未觀察到過(guò)敏反應。對(duì)于非臨床研究結果外推臨床的提示性價值可能(néng)要考量種(zhǒng)屬免疫系統的差異性。基于核苷酸藥物設計的不同,在ASO藥物的非臨床研究中,提前關注可能(néng)的過(guò)敏反應。
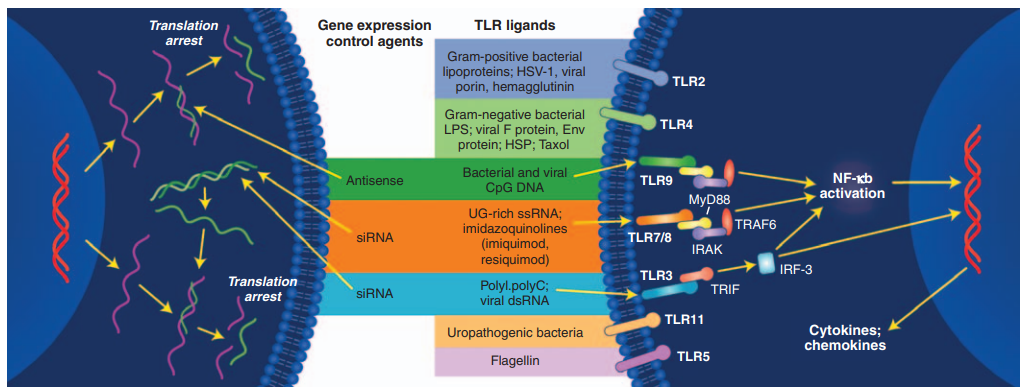
圖2. 反義寡核苷酸介導的TLR途徑
血小闆減少在PS-ASO藥物的非臨床研究中較常見[7],如表3所示。
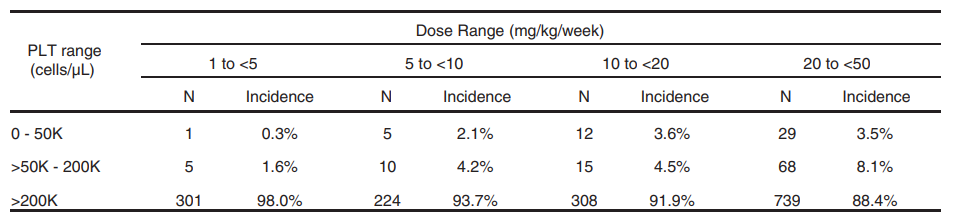
表3. NHPs在不同濃度ASO藥物處理後(hòu)
在指定範圍内的PLT計數發(fā)生率
PS-ASO藥物的NHPs的回顧性分析表明血小闆減少症表現劑量依賴性,且一定程度上表現序列相關性。通過(guò)非臨床與臨床試驗中血小闆減少的轉化研究表明,NHPs可以進(jìn)行嚴重血小闆減少症的風險預測,更多血小闆功能(néng)的風險與控制及對(duì)血凝系統的影響仍需要基于臨床研究數據判斷。
血小闆活化在體外可通過(guò)流式細胞術測定富含血小闆的血漿中P-選擇素(CD62P)和PAC-1(活化的GPIIb\/IIIa)的活化來确定。由于體外血小闆活化僅代表潛在風險,臨床上沒(méi)有充分驗證轉化爲血小闆減少症,因此這(zhè)些讀數隻能(néng)作爲從具有不同效力的分子庫中選擇最佳小核酸藥物的篩選标準。
基于ASO藥物自身特性,在系統暴露後(hòu),藥物通常在肝髒和腎髒出現蓄積。在非臨床研究中,動物肝髒和腎髒出現細胞空泡化以及嗜堿性顆粒(被吞噬的寡核苷酸)屬于ASO類藥物常見改變,對(duì)非臨床安全劑量的确定權重有限。但ASO藥物導緻的ALT和AST明顯升高,則提示藥物引起(qǐ)明顯的肝損傷。
由于大多數ASO藥物更傾向(xiàng)于通過(guò)腎髒清除,在超過(guò)一半以上的ASO上市藥物中,腎小管出現了壞死,退化/再生等損傷,因此藥物的腎毒性被FDA列爲了黑框警告。究其原因,PS-ASO藥物的肝腎毒性主要由其序列設計中更高親和力的LNA和cEt等化學(xué)修飾核苷酸所引起(qǐ)[8],如表4所示。
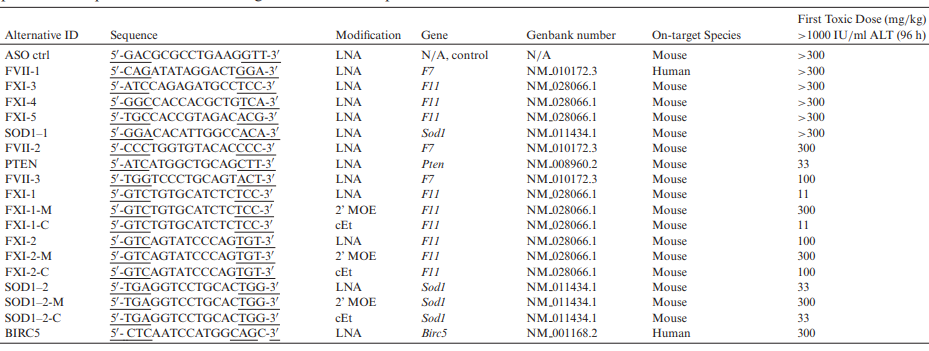
表4. 不同序列和修飾的PS-ASO藥物的肝髒毒性彙總
高暴露器官的毒性可通過(guò)體外預測模型以及檢測早期毒性生物标志物來做臨床前的安全性評估,此外,也可通過(guò)在不損失藥物效力的情況下進(jìn)行設計修改來降低ASO藥物毒性。
03 雜交與序列無關因素
凝血功能(néng)的改變也是ASO藥物不良反應之一。Nusinersen可見給藥後(hòu)的凝血異常。凝血抑制通常由達到阈值水平以上的血漿濃度驅動,其發(fā)生的主要原因是由于PS-ASO類藥物的PS主鏈可通過(guò)抑制因子IXa磷脂複合物激活因子X或影響因子VIIIa的磷脂親和力從而抑制凝血級聯反應中的Tenase複合物(因子IXa和輔助因子VIIIa),進(jìn)而選擇性的抑制了部分凝血酶的作用時間,從而以一種(zhǒng)與雜交和序列無關的方式抑制凝血反應[9][12]。
與凝血抑制類似,含有PS主鏈的ASO藥物,如Mipomersen可與血漿補體因子H相互作用,降低了補體級聯反應抑制劑的水平,導緻級聯反應不受控制的擴增。藥物導緻的補體過(guò)度激活可導緻C3的耗竭,從而使補體功能(néng)改變,引發(fā)繼發(fā)性炎症和血管炎[13][14],如圖3所示。
圖3. ASO藥物誘導的C3耗竭導緻繼發(fā)性炎症
凝血抑制可通過(guò)體外藥物與檸檬酸血清孵育後(hòu)測量凝血酶原時間(PT)和活化部分凝血活酶時間(APTT)來評估。而補體活化則可通過(guò)在小鼠、NHP或人的血清、血漿或全血中孵育候選藥物後(hòu),用 ELISA測定補體途徑(Bb、C3a和C5a)的不同分裂産物來評估。這(zhè)類毒性在臨床研究中并非常見,在大多數情況下,可以通過(guò)調整給藥方案來減少對(duì)臨床安全性的影響。
04 給藥途徑相關因素(中樞神經(jīng)系統局部給藥相關的毒性)
常用的中樞神經(jīng)系統給藥途徑是鞘内給藥(IT),在齧齒類動物模型中則是側腦室内給藥(ICV)。與全身給藥相比,中樞神經(jīng)系統給藥總體給藥劑量較低,因此導緻的外周毒性風險也較低,但會導緻脊髓液和大腦中藥物濃度立即達到高濃度且持續較長(cháng)時間,從而導緻大腦誘導出現持續時間較長(cháng)的免疫應答以及神經(jīng)毒性。
這(zhè)類毒性主要由ASO藥物3’-鳥嘌呤核苷酸的數量和位置決定。現階段神經(jīng)毒性評估主要通過(guò)小鼠以及體外培養的原代神經(jīng)元,但因爲小鼠和人類神經(jīng)元和非神經(jīng)元細胞中表達的RNA存在顯著差異,很難從動物模型中預測人體毒性,因此爲了更好(hǎo)地預測ASO藥物的神經(jīng)毒性,還(hái)需要在動物和人類細胞模型中進(jìn)行更多的研究。
05 其他因素
雖然當前對(duì)ASO藥物引起(qǐ)肝毒性、腎毒性和超敏反應有了一些了解與推測,但在遺傳水平上涉及毒性病變的精确分子和生化事(shì)件尚不清楚。如ASO藥物引起(qǐ)毒性過(guò)程中發(fā)生的潛在分子事(shì)件是否影響其他小分子藥物的ADME,改變其治療效果,采用何種(zhǒng)藥理作用機制的藥物可以降低該風險等。
結語
非臨床安全性評估的目标是預測臨床中潛在的安全風險。ASO藥物的相關毒性主要取決于其序列設計、化學(xué)修飾、給藥劑量和給藥途徑等。對(duì)于不同設計的藥物,在臨床前研究中需要從不同方面(miàn)來考量和評估其安全性。
在已評估的3類因素中,雜交和序列相關因素在藥物設計時應被優先考慮,雜交和序列無關因素則可在臨床應用過(guò)程中通過(guò)調整給藥方案來規避,而雜交無關但序列相關因素的擔憂則需要在非臨床及臨床階段受到重點關注。
到目前爲止,大多數ASO藥物都(dōu)是用于治療沒(méi)有其他治療手段的罕見性疾病,這(zhè)使得藥物的安全性風險考量在一定程度上讓位于其治療效益。但随着更多的用于常見疾病治療的藥物靶點的發(fā)現,更有效力和更敏感的體外模型的開(kāi)發(fā)以及對(duì)不同毒性潛在機制的日益了解,對(duì)ASO藥物的安全性評估將(jiāng)會更加嚴格,這(zhè)也將(jiāng)進(jìn)一步改進(jìn)開(kāi)發(fā)安全有效的ASO藥物的過(guò)程,并促進(jìn)ASO藥物的更長(cháng)遠的發(fā)展。
參考資料:




































