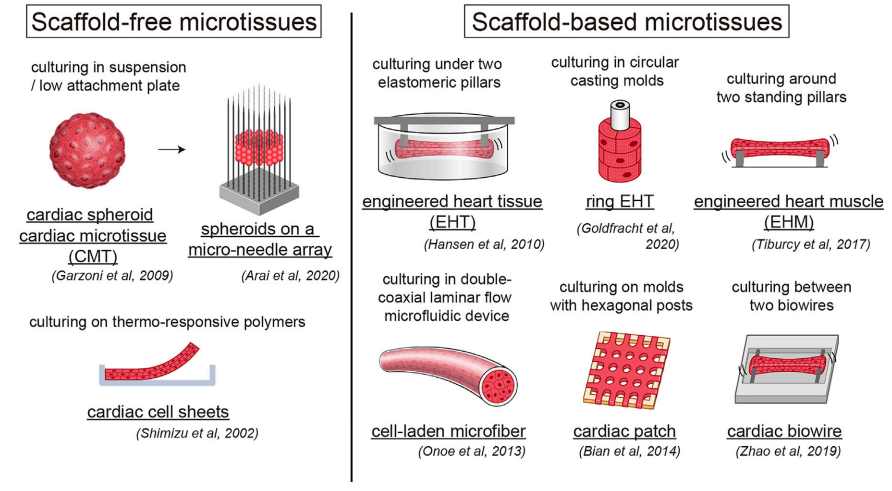
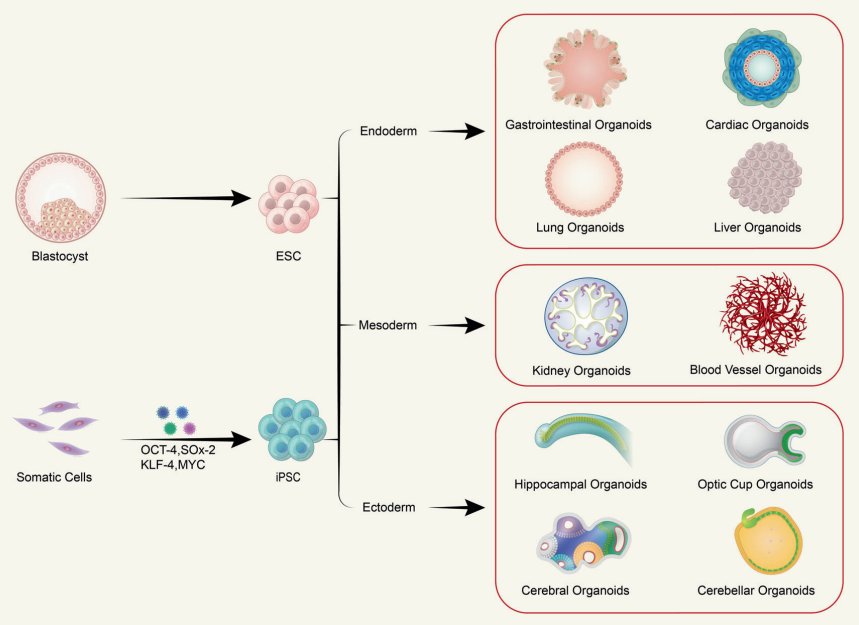
從iPSCs到類器官 類器官(Organoids)作爲幹細胞研究領域最重要的成(chéng)果之一,在基礎醫學(xué)研究、轉化醫學(xué)及藥物研發(fā)領域展現出巨大的應用潛力,特别是在精準醫療以及藥物安全性和有效性評價等方向(xiàng)憑借其先天優勢引起(qǐ)了極大的市場關注,成(chéng)爲各大藥物研發(fā)機構、CRO公司争相布局的戰略點。 随着FDA批準了全球首個完全基于“類器官芯片”研究獲得臨床前數據的新藥(NCT04658472)進(jìn)入臨床試驗這(zhè)一裡(lǐ)程碑事(shì)件的發(fā)生,類器官及類器官芯片(Organoids-on-Chips,OoCs)更是有望成(chéng)爲突破臨床前藥物開(kāi)發(fā)限制的革新技術,而掌握這(zhè)種(zhǒng)技術革新的藥物公司,如賽諾菲和Hesperos器官芯片公司,在一定程度上將(jiāng)會改變藥物研發(fā)的現有周期和技術規則。 類器官技術由來已久。早在2009年,Hans Clevers實驗室就使用單個鼠Lgr5+腸幹細胞在體外自組織成(chéng)爲具有腸隐窩-絨毛結構的腸類器官,這(zhè)一技術當時并未引起(qǐ)廣泛的關注和讨論。直到應用誘導多能(néng)幹細胞(induced Pluripotent Stems Cells, iPSCs)在體外成(chéng)功構建出多個特定疾病的模型後(hòu),類器官技術又重新引起(qǐ)生物醫藥領域的研究熱潮。 現有類器官主要分爲兩(liǎng)類:組織來源類器官和多能(néng)幹細胞來源類器官。 組織來源的類器官最爲大衆熟知的是病人來源的類器官(Patient-Derived Organoids, PDOs),由于該方法現主要被用于腫瘤疾病模型構建,因此常被稱爲腫瘤類器官。 因腫瘤類器官是直接從患者體内獲取腫瘤組織後(hòu),選擇合适的細胞外基質後(hòu)培育而成(chéng),所以可以很好(hǎo)地保留個體之間的腫瘤異質性,目前已有包括結直腸癌、胰腺導管腺癌、乳腺癌、前列腺癌、肝癌等在内的多個組織腫瘤類器官庫。 借助于腫瘤類器官庫的構建,使之成(chéng)爲開(kāi)放平台性質的腫瘤研究資源,從而用于檢測抗腫瘤藥物的作用效果及對(duì)正常組織的毒副作用,是現有腫瘤類器官的主要研究模式。 不難看出,腫瘤類器官更多地將(jiāng)是在臨床個體化治療方向(xiàng)發(fā)揮其獨特的作用。 腫瘤類器官在臨床前研究和臨床實驗中的應用[1] 多能(néng)幹細胞來源的類器官主要由成(chéng)體幹細胞(Adult Stem Cells, AdSCs)、胚胎幹細胞(Embryonic Stem Cell,ESCs)和iPSCs構成(chéng)。 AdSCs構建類器官簡便快捷且培養體系相對(duì)簡單,但缺點是分化能(néng)力有限,且AdSCs類器官一般僅含有器官的上皮部分,缺乏基質、神經(jīng)和血管系統,無法滿足大部分研究需求;ESCs構建的類器官是經(jīng)過(guò)定向(xiàng)分化所産生,可更爲完整地在體外模拟器官的生理功能(néng),但缺點是存在明顯的倫理和法律問題,iPSCs可很好(hǎo)地解決上述問題。iPSCs可從皮膚、血液及尿液樣本中得到的成(chéng)纖維、PBMC等細胞經(jīng)重編程技術獲得,并可在體外定向(xiàng)分化爲功能(néng)細胞後(hòu)組裝爲類器官。 因此,iPSCs極大地促進(jìn)了類器官技術的發(fā)展,也促使基因編輯技術可更全面(miàn)地用于類器官研究,方便研究人員在體外構建帶有特定突變位點的疾病模型。 ➡ 多能(néng)幹細胞來源的多種(zhǒng)功能(néng)細胞, 可在體外構建成(chéng)不同的類器官[2]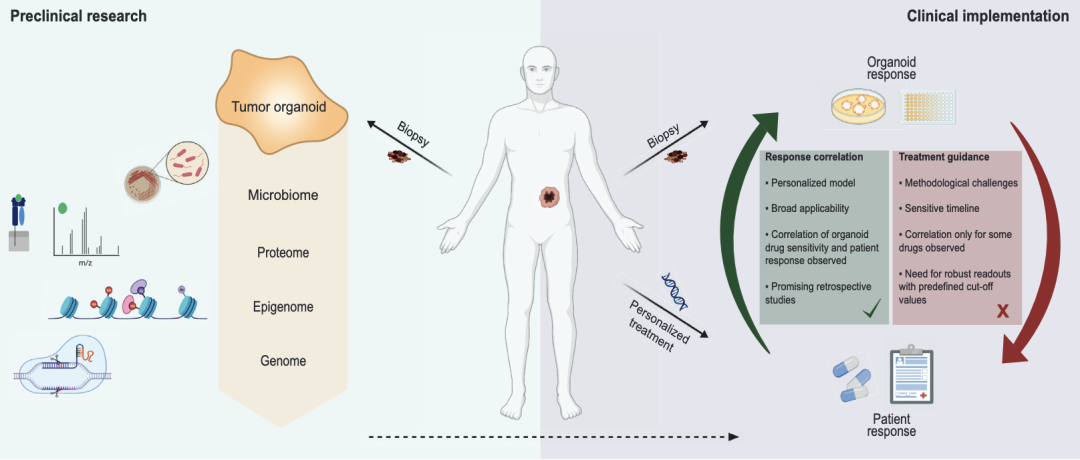
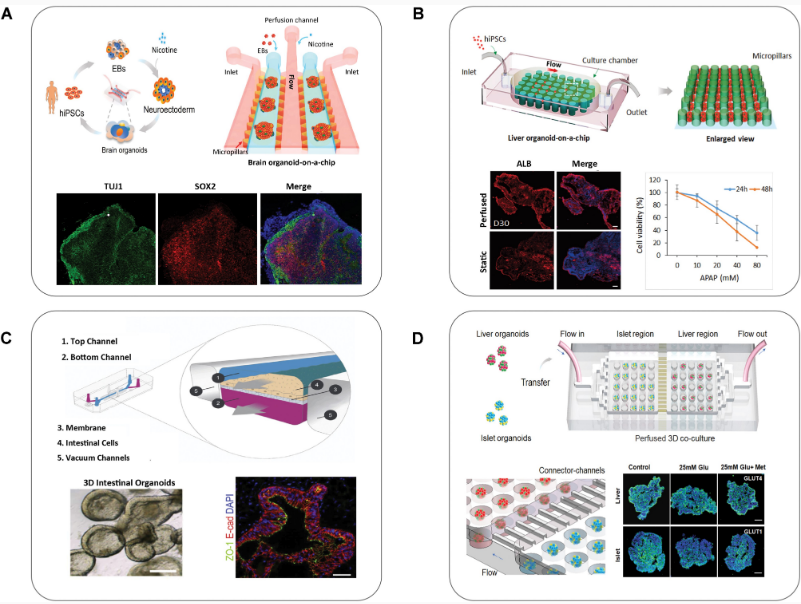
爲什麼(me)類器官技術 將(jiāng)在藥物研發(fā)過(guò)程中擁有一席之地? | 類器官技術的研究背景 全球現有超過(guò)7000餘種(zhǒng)的罕見病仍沒(méi)有明确的治療方法,這(zhè)其中隻有約400種(zhǒng)正在進(jìn)行臨床療效研究,覆蓋率不足10%。罕見病的治療方法研究受限最主要原因就是缺乏可靠的體外疾病研究模型,對(duì)于腫瘤、心血管疾病因其發(fā)病機制和疾病表型的特殊性,仍面(miàn)臨着大量體外模型的缺失問題。 盡管動物模型在過(guò)去的百餘年裡(lǐ)已成(chéng)功應用于生物醫學(xué)領域,爲識别潛在的藥物靶點、研究信号通路的傳導以及闡明疾病的潛在病理機制提供了不可替代的背景數據,但其不足也十分明顯:比如人類和動物之間存在的物種(zhǒng)差異;動物試驗的研發(fā)周期普遍冗長(cháng)且成(chéng)本高昂,面(miàn)臨着日趨嚴重的倫理問題;以及一部分新藥雖在動物試驗中被證明了安全有效,卻在臨床試驗中以失敗告終。 同時,傳統的動物模型或二維細胞模型,越來越無法滿足細胞治療、基因治療等創新藥物的研發(fā)需求。 因此,如果說有一項技術可以有效縮短藥物研發(fā)周期、降低藥物研發(fā)成(chéng)本并同時帶來更爲可靠的非臨床試驗數據,那麼(me)類器官技術極有可能(néng)將(jiāng)是其中之一。早在2013年,類器官就被Science評爲年度十大技術,2018年初被Nature Method評爲2017年度最佳研究方法。近年來,類器官更是各頂級研究期刊上的常客,在PubMed上搜索類器官相關詞條,大約有2萬餘條文獻數據,且在2018年左右就呈現逐年遞增的井噴式增長(cháng),可見其研究熱度。中國(guó)發(fā)表的類器官相關文獻數量在2020年位列全球第二,僅次于美國(guó)。足以見得中國(guó)類器官技術的科研積累,將(jiāng)在不遠的將(jiāng)來加速類器官産業化的整體進(jìn)程。 PubMed上類器官相關文獻發(fā)表情況 | 從類器官到OoCs 從類器官技術誕生至今,三維類器官培養技術已經(jīng)在體外成(chéng)功培養出了如腎、肝、肺、腸、腦、心髒、前列腺、胰腺、視網膜等具有大部分關鍵生理結構和功能(néng)的類組織器官。同時,基于微流控技術的器官芯片(Organ-on-a-Chip)也在建模的可控性和标準化上顯現出其獨有的優勢,即可實現更爲複雜的器官模型構建。 在以上技術背景下,OoCs技術應運而生,它整合了類器官和器官芯片兩(liǎng)種(zhǒng)技術的優勢,在芯片上即可構建出相對(duì)完整的生理微系統,在體外成(chéng)功再現相互關聯的器官功能(néng),從而更爲全面(miàn)的預測藥物或化合物對(duì)人體所産生的作用。 Hesperos公司推出的Human-On-A-Chip類器官芯片培養系統 最近發(fā)表在Life Medicine上的綜述文章系統全面(miàn)描述了如何將(jiāng)器官芯片技術與類器官結合,實現類器官工程的策略和方法,闡明了OoCs不僅可以爲深入理解器官生理和病理特征提供獨特的見解,還(hái)可通過(guò)整合多功能(néng)分析方法,助力于多尺度動态監測培養環境和複雜生物學(xué)過(guò)程以實現高通量藥物篩選,爲組織器官修複、疾病治療和再生醫學(xué)的發(fā)展提供有力的技術支持和保障。 OoCs的代表類型和功能(néng)[3] 至此,不難理解爲何NIH、FDA等早在2011年就牽頭推出“MPS(微生理系統)計劃”、歐盟資助的研發(fā)聯盟imSAVAR的目标之一就是與大型藥企合作開(kāi)發(fā)器官芯片模型。從技術背景來看,研究者們普遍認爲類器官及OoCs這(zhè)一新興技術擁有巨大應用潛力,將(jiāng)助力新藥的靶點研究、爲體外疾病模型構建提供新的視角,同時爲預測新藥的有效性和安全性、探索物種(zhǒng)的差異性和意外的臨床表現提供新思路。 | 類器官相關政策 從2021年開(kāi)始,中國(guó)也正式從科研和監管兩(liǎng)個層面(miàn)同時推進(jìn)器官芯片技術的發(fā)展。 2021年11月,CDE在《基因治療産品非臨床研究與評價技術指導原則(試行)》中首次推薦將(jiāng)類器官列入基因治療産品的非臨床藥理學(xué)研究, “如果沒(méi)有合适的動物模型滿足試驗需要,應當依據科學(xué)原理開(kāi)發(fā)相應的動物模型或使用更完善的體外試驗系統、替代性模型(例如類器官)開(kāi)展試驗”。 2022年7月,由中國(guó)抗癌協會腫瘤标志專業委員會等機構聯合發(fā)布的《類器官藥物敏感性檢測指導腫瘤精準治療臨床應用專家共識(2022年版)》及由中國(guó)抗癌協會腫瘤多學(xué)科診療專業委員會、中國(guó)抗癌協會腫瘤内分泌專業委員會聯合正式發(fā)布的《腫瘤類器官診治平台的質量控制标準中國(guó)專家共識(2022年版)》标志着腫瘤類器官技術在指導患者臨床治療的需求日趨增長(cháng)。 CDE官網發(fā)布的《基因治療産品非臨床研究與評價技術指導原則(試行)》 2022年6月,美國(guó)衆議院通過(guò)的《H.R.7667 - Food and Drug Amendments of 2022》法案中對(duì)“非臨床實驗”明确了定義:藥物臨床試驗階段之前或期間進(jìn)行的體外實驗或非人類體内實驗,也首次將(jiāng)器官芯片和微生理系統(Organ chips and microphysiological systems)作爲獨立的藥物非臨床實驗評估體系納入法案,器官芯片和細胞模型、計算機建模以及動物模型等視爲同等重要的研究手段,這(zhè)一方案的通過(guò),更是确定了類器官及器官芯片在未來藥物研發(fā)中的關鍵作用。 在過(guò)去十年裡(lǐ)對(duì)于類器官技術的研究大部分集中在實驗室條件下,甚少有應用在臨床藥物研發(fā)中,其中的原因除去技術壁壘和多學(xué)科交叉外,最大的限制條件就是缺乏監管和法規層面(miàn)的認可;如今這(zhè)些法規的陸續出台,無疑是從監管層面(miàn)确定了類器官及類器官芯片在藥物研發(fā)中的特殊位置。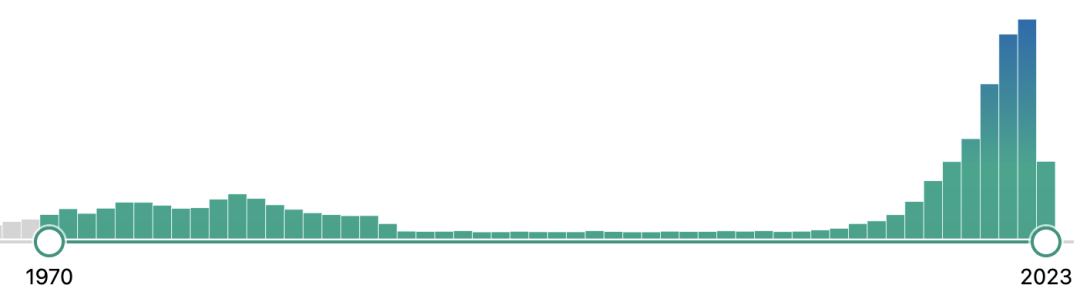


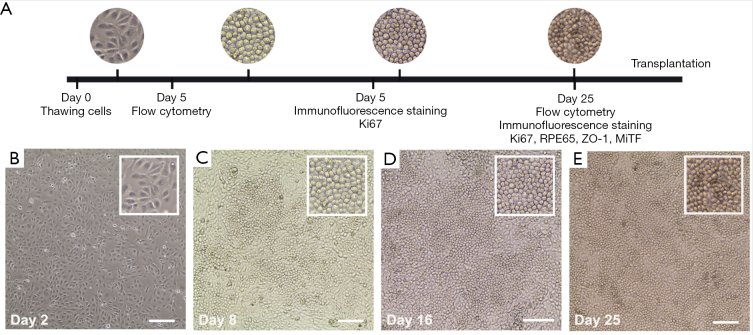
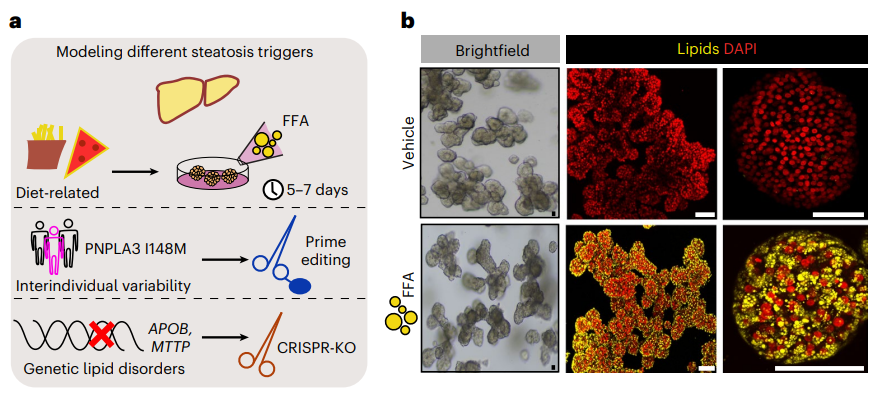
現有類器官研究進(jìn)展 從類器官誕生至今,3D類器官培養技術已經(jīng)在體外成(chéng)功培養出了如腎、肝、肺、腸、腦、心髒、前列腺、胰腺、視網膜等具有大部分關鍵生理結構和功能(néng)的類組織器官,并已有部分應用于藥物篩選、個性化精準醫療、再生醫學(xué)等方向(xiàng)的研究,以下則主要從三個方向(xiàng)的類器官研究進(jìn)展進(jìn)行詳細展開(kāi)。 01 心髒類器官 據《中國(guó)心血管健康與疾病報告2021》顯示,我國(guó)心血管疾病的發(fā)病率與緻死率仍高居榜首,每5例死亡中就有2例死于心血管疾病,推算心血管疾病患者人數在3.3億左右。相比居高不下的患病率,心血管藥物的開(kāi)發(fā)卻正在逐年減少,其中很大的一個原因就是難以在藥物研發(fā)的初期就準确評估藥物可能(néng)産生的作用,這(zhè)不僅僅是因爲心髒大小、心率和離子通道(dào)表達在人類和動物模型之間存在顯著差異,還(hái)因爲導緻人類罹患心血管疾病或使其易于罹患心血管疾病的變異體和突變對(duì)轉基因小鼠産生的影響不一緻。 iPSCs分化的心肌細胞所構建的心髒類器官,可以很好(hǎo)地解決上述問題。 2021年發(fā)表在Cell Stem Cell上的研究就提出由iPSCs培育出的心髒類器官與胎兒心髒高度相似,因這(zhè)種(zhǒng)心髒類器官含有腸細胞,可很好(hǎo)地促進(jìn)心髒類器官的成(chéng)熟化,此種(zhǒng)組織結構的類器官能(néng)在體外培養皿中存活超過(guò)1年,可作爲長(cháng)期實驗室研究的穩定體系[4]。 基于多電極微陣列系統(MEA)技術,研究者們進(jìn)行了一項國(guó)際化研究,使用28種(zhǒng)随機化合物,在多個實驗室評估化合物對(duì)iPSCs分化的心肌細胞的作用,以上實驗得出的數據,支持CiPA(體外緻心律失常測定)比目前的S7B/E14指南更準确地預測心律失常風險。同時,也有研究者在Cell Stem Cell發(fā)表文章,闡述他們基于96孔闆,培養心髒心肌類器官,進(jìn)而進(jìn)行化合物篩選的新流程,即基于心髒類器官,可以同時篩選上千種(zhǒng)化合物。 因此,使用不同類型的心髒類器官對(duì)藥物進(jìn)行高通量篩選,可極大的縮短特定心血管疾病治療藥物的研發(fā)周期,同時可提供更爲貼近患者的用藥狀态的非臨床數據。 多種(zhǒng)心髒類器官的形态和組成(chéng)方式[5] 02 視網膜器官 視網膜是眼睛高度複雜的層壓結構,其最重要的功能(néng)是將(jiāng)光能(néng)轉化爲視覺感知。在眼睛發(fā)育過(guò)程中,從神經(jīng)外胚層發(fā)育而來的視溝深入并形成(chéng)稱爲視囊泡的腔室。後(hòu)者向(xiàng)内移動,形成(chéng)雙層杯形結構,稱爲光學(xué)杯。視杯由外視網膜色素上皮和内神經(jīng)視網膜組成(chéng)。 經(jīng)過(guò)十幾年的研究探索,科學(xué)家們成(chéng)功地開(kāi)發(fā)出了在結構和功能(néng)上都(dōu)與真正的視網膜非常相似的視網膜類器官。研究者通過(guò)使用特定的神經(jīng)化因子直接分化多能(néng)幹細胞,讓視網膜層壓結構重新聚集,使視網膜類器官顯示出對(duì)光刺激的生理反應。 最近的一項研究建立了一個從人類來源的iPSCs獲得含視囊泡的腦類器官(OVB類器官)的方案。OVB類器官由許多不同的發(fā)育中的視囊泡細胞類型組成(chéng),包括視網膜祖細胞、視網膜色素上皮細胞、晶狀體樣細胞和原始角膜上皮細胞。研究者發(fā)現OVB類器官的光敏活性可以由各種(zhǒng)光強度觸發(fā)。 而國(guó)内科學(xué)家于2021年發(fā)表的研究結果表明,已可以將(jiāng)GMP級人類iPSCs來源的視網膜色素上皮細胞移植到齧齒動物模型中[6]。這(zhè)不僅爲治療年齡相關性黃斑變性(AMD)或篩選對(duì)AMD有治療效果的藥物提供了紮實的實驗室研究基礎,也爲視網膜類器官的産業化提供了技術背景。 視網膜細胞的培養過(guò)程 03 肝髒類器官 肝髒是僅在脊椎動物中發(fā)現的主要器官,其主要功能(néng)細胞類型是内胚層來源的肝細胞和膽管細胞。在2011年,Hans Clevers就在一定程度上建立了具有肝膽器官發(fā)生的自組裝人肝類器官模型,并進(jìn)一步發(fā)現Lgr5+成(chéng)肝細胞可以分化成(chéng)胚胎肝類器官,從而産生肝細胞和膽管細胞後(hòu)代。最近,研究者建立了一種(zhǒng)在體外生成(chéng)含有功能(néng)性膽汁小管系統的肝類器官的方法,并模拟曲格列酮誘導的膽汁淤積。 人源iPSCs-HLC模型已被用于模拟α1-抗胰蛋白酶缺乏症中ER的破壞和尿素循環缺陷,使用CRISPR/Cas9 技術糾正患者特異性細胞以消除疾病特征。這(zhè)些生物工程模型的成(chéng)功,以及iPSCs-HLC的功能(néng)活性通過(guò)球狀肝髒類器官和肝髒器官芯片技術的發(fā)展,使得肝髒類器官在轉化研究和藥物研發(fā)中的應用更爲多樣化。 由Hans Clevers實驗室發(fā)表在Nature Biotechnologyy的研究顯示其在體外成(chéng)功建立了基于CRISPR/Cas9基因編輯技術的非酒精性脂肪肝病模型(NAFLD)平台- FatTracer,以及使用APOB−/−和MTTP−/−類器官的推測靶點,這(zhè)一類器官模型將(jiāng)有助于研究脂肪變性的病因和篩選有效治療藥物靶點。 基于CRISPR/Cas9基因編輯技術的非酒精性脂肪肝病模型(NAFLD)[7] 專病領域的藥物研發(fā)所面(miàn)臨的機遇和挑戰 | 類器官的市場機遇 類器官在商業市場的應用主要是創新藥物的研發(fā)及拓展适應症等方向(xiàng),CRO公司與類器官技術有天然的技術連接,即作爲向(xiàng)制藥企業提供新藥的臨床或臨床前研究等服務的專業機構,借力類器官來構建一體化服務平台是十分必要的布局點。 類器官及類器官主要的商業模式,除卻由高校頂尖的研發(fā)人員成(chéng)立技術公司外,越來越多的藥企通過(guò)購買類器官産品或者投資等形式直接進(jìn)入類器官芯片賽道(dào),比如2022年3月,賽諾菲與Prellis達成(chéng)合作,利用其平台在體外重建免疫反應以提供具有顯着遺傳多樣性的抗體。 此外,由艾伯維、默克、諾華等20餘家TOP藥企共同成(chéng)立非營利組織IQ聯盟(Innovationand Quality Consortium),緻力于推動類器官芯片的标準化應用,以加速藥物研發(fā)進(jìn)程。目前已針對(duì)肝髒、腎髒、肺等模型發(fā)表一系列行業标準。 從2019年開(kāi)始,國(guó)内的資本市場,也開(kāi)始關注類器官這(zhè)個賽道(dào):創芯國(guó)際完成(chéng)近億元A輪融資;大橡科技完成(chéng)數千萬元的A輪融資;恒瑞醫藥的轉化醫學(xué)部門,建立了體外類器官培養(Organoid Culture)部門,可以在模拟的人體器官及腫瘤微環境中進(jìn)行藥物研究;2020年,默克中國(guó)創新中心開(kāi)始探索創新“類器官”平台。 類器官技術能(néng)夠在一定程度幫助藥企做風險管理,達到降本增效、提高藥物研發(fā)成(chéng)功率的目的,但基于類器官整個行業都(dōu)處于較早期階段,國(guó)内仍沒(méi)有形成(chéng)集中化的産業群,因此,擁有核心技術和完整産業鏈、并盡早在該行業布局的企業將(jiāng)具有一定的先發(fā)優勢,并在將(jiāng)來建立相關行業标準時,可掌握主導優勢和話語權。 | 類器官所面(miàn)臨的挑戰 但,類器官這(zhè)一新興技術,仍存在着多方面(miàn)的不足。 從類器官技術層面(miàn)來講,首先,部分體外培養的類器官缺乏血管化和免疫系統,随着類器官體積的增長(cháng),類器官受限于氧氣的缺失以及代謝廢物的增加,可能(néng)導緻組織壞死;血管化以外的難點還(hái)包括模拟腫瘤和免疫環境的相互作用關系,雖有研究顯示,可通過(guò)與免疫細胞共培養以解決這(zhè)一技術瓶頸,但這(zhè)種(zhǒng)方式是否适合用于類器官批量化生産仍然未知[8];其次,由于行業标準的欠缺及空白,現階段類器官的重複性和一緻性問題也亟待解決。此外,傳統制備法不能(néng)很好(hǎo)地複制器官發(fā)展過(guò)程中複雜且動态的微環境,而這(zhè)種(zhǒng)微環境恰恰是器官形成(chéng)的必要因素。 從藥物研發(fā)角度來講,類器官或類器官芯片更像是患者的替身,可以作爲藥物研發(fā)的“Phase 0”—準臨床試驗,可提高藥物臨床的試驗成(chéng)功率,研究者近期發(fā)表在Science上的文章通過(guò)在71位轉移性胃腸道(dào)癌提取了110份組織構建了腫瘤類器官,測試了55種(zhǒng)抗癌藥物,結果顯示,腫瘤類器官藥篩達到了93%的特異性[9]。以上研究結果更多的體現在腫瘤藥物的研發(fā)中,是否可以推行到更爲多樣化的新藥研發(fā)全生命周期中仍是未知。 從臨床應用角度來講,腫瘤類器官很難完美模拟出原腫瘤的全部功能(néng)。腫瘤組織在人體中以高度異質性的複雜結構存在,現階段的類器官仍無法在體外完全體現出不同類型腫瘤的異質性;通過(guò)多能(néng)幹細胞構建的多種(zhǒng)類器官組織,雖可以在體外展現出大部分器官的生理功能(néng),但仍需要使用外源性的人工細胞外基質(extracellular matrix,ECM),批次間的變化以及ECM中機械性能(néng)的局部變化會將(jiāng)差異引入類器官培養物,導緻類器官的變異性,極大地限制了臨床使用和類器官人體移植。 | 專病領域的類器官,我們能(néng)做些什麼(me)? 那麼(me),現階段面(miàn)對(duì)類器官及OoCs,是不是一定要等到其技術完全成(chéng)熟後(hòu),我們才能(néng)將(jiāng)其應用到藥物研發(fā)或個體化醫療中? 答案并不盡然。 從創新藥物的研究角度來看,并不應將(jiāng)類器官或者OoCs技術理解爲對(duì)實驗動物的單一“替代”, 對(duì)于如眼科、心髒及肝髒等專病領域,多模型整合才是現階段可能(néng)幫助轉化醫學(xué)研究突破“死亡谷”的最佳解決方案,基于原位組織和動物模型的研究仍是生物醫學(xué)及藥物研發(fā)領域的黃金标準,類器官及OoCs技術更應與這(zhè)種(zhǒng)标準相互結合,發(fā)揮其獨特的優勢,助力創新藥物的研發(fā)。 近期發(fā)布的各項研究均表明,基于類器官或OoCs技術,結合多種(zhǒng)模型的研究頗有成(chéng)效:Cell Stem Cell上的文章指出自組織心髒類器官可做爲揭示人類心髒發(fā)育、研究心血管疾病、測試藥物和移植的強大工具[10];從iPSCs生成(chéng)的三維淚腺類器官可爲眼科類器官模型提供更爲仿真的生理結構,從而有助于特定疾病的研究和治療藥物的篩選[11]。 因此,結合現有的動物試驗基礎和豐富的非臨床背景數據庫,針對(duì)創新藥物的研發(fā),類器官或OoCs在現階段可以逐步應用于以下幾個方向(xiàng): 1. 基于微流控芯片技術的心髒/肝髒類器官的藥物篩選或藥效檢測:微流控芯片上的類器官比傳統的動物試驗更具成(chéng)本效益,同時相較傳統類器官培養檢測而言,可用更小的組織量測更多的指标;能(néng)夠控制細胞和特定組織結構,好(hǎo)模拟體内環境和反應;可内嵌組織功能(néng)傳感器,便于監測健康狀态與動态。 2. AI計算結合高通量化合物篩選,賦能(néng)類器官或類器官芯片的各個環節:未來將(jiāng)AI、自動化技術結合微流控芯片形成(chéng)軟硬件集成(chéng)的智能(néng)解決方案將(jiāng)爲高通量藥物篩選、非臨床試驗的背景數據庫檢索分析及特定治療藥物的早期預測等提供更爲紮實可信的技術基礎。 3. 專病領域生物樣本庫(Biobank)的構建:Biobank的建立使生物學(xué)相關的藥物篩選成(chéng)爲可能(néng),利于將(jiāng)科研成(chéng)果轉化爲實際的市場應用。通過(guò)構建如眼科、肝髒疾病的特定Biobank,將(jiāng)使特定藥物的高通量體外篩選(如mRNA、細胞治療及免疫治療類藥物)成(chéng)爲可能(néng),也可通過(guò)構建特定疾病的Biobank,使靶向(xiàng)性藥物篩選的陽性率顯著提升,從而極大程度的節約藥物研發(fā)成(chéng)本、縮短藥物研發(fā)周期。 對(duì)于藥企和CRO公司來講,通過(guò)現有的成(chéng)熟動物模型(如大、小鼠及非人靈長(cháng)類等),與類器官及OoCs技術的先天優勢相結合,和現有的實驗動物數據相互補充結合,實現高質量、高通量的藥物篩選、藥物藥理及毒理檢測,使藥物非臨床試驗數據,在最大程度上體現臨床研究價值,是現階段類器官及OoCs可在專病領域最有可能(néng)實現的轉化醫學(xué)價值。 參考資料: