


上一期,鼎泰集團對(duì)多個已上市ADC藥物(小分子毒素爲微管抑制劑)的非臨床研究路徑進(jìn)行了彙總和複盤(點擊查看)。本期我們將(jiāng)分享已上市的以DNA拓撲異構酶1抑制劑爲Payload 的ADC藥物(TOP1-ADC) Enhertu(靶向(xiàng)HER2, Payload爲DXd) 和 Trodelvy(靶向(xiàng)Trop2, Payload爲SN-38) 的上市曆程和分階段支持IND和BLA的非臨床研究内容。 期待通過(guò)本期分享,加深對(duì)相關指南的深度理解和具體産品研究方案的精準把握,并期待與廣大業内同行一起(qǐ)交流、探讨,共同推動ADC産品的開(kāi)發(fā)。如有不準确之處,歡迎同行提出寶貴意見,我們會持續改進(jìn)。 喜樹堿來源的TOP1,如拓撲替康(Topotecan)、伊立替康(Irinotecan)、貝洛替康(Belotecan)已被批準用于治療非小細胞肺癌、卵巢癌和結直腸癌[1]。Deruxtecan(DXd+linker)、Exatecan、SN-38(Irinotecan的活性代謝産物) 尚未單獨批準上市,常作爲喜樹堿類Payload用于ADC藥物的開(kāi)發(fā)。
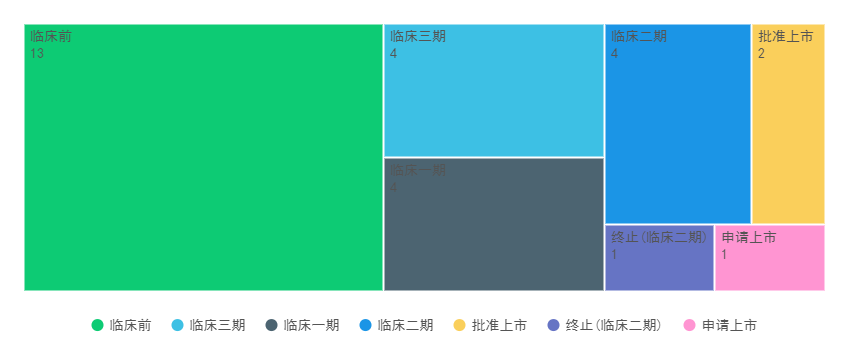
喜樹堿及其衍生物的化學(xué)結構[1] (A) Camptothecin(CPT), (B)Topotecan, (C)Irinotecan(CPT-11), (D)SN-38, (E) Belotecan, (F)Exatecan(DX-895), (G)Deruxtecan(DX-8951 (DXd)+ maleimide-GGFG peptide linker) TOP1-ADC由于具有獨特作用機制的細胞毒作用、高DAR、強的旁觀者和穩定且能(néng)被特異性切割的連接子,已成(chéng)爲ADC藥物開(kāi)發(fā)的重點方向(xiàng)。目前,全球範圍内已有2個以TOP1抑制劑爲Payload的ADC藥物(TOP1-ADC)上市;至少1個TOP1-ADC提交了上市申請;多個TOP1-ADC處于不同階段的臨床試驗中。 全球TOP1-ADC的臨床研發(fā)進(jìn)展 (鼎泰集團根據藥渡數據整理,截至2023.12.28)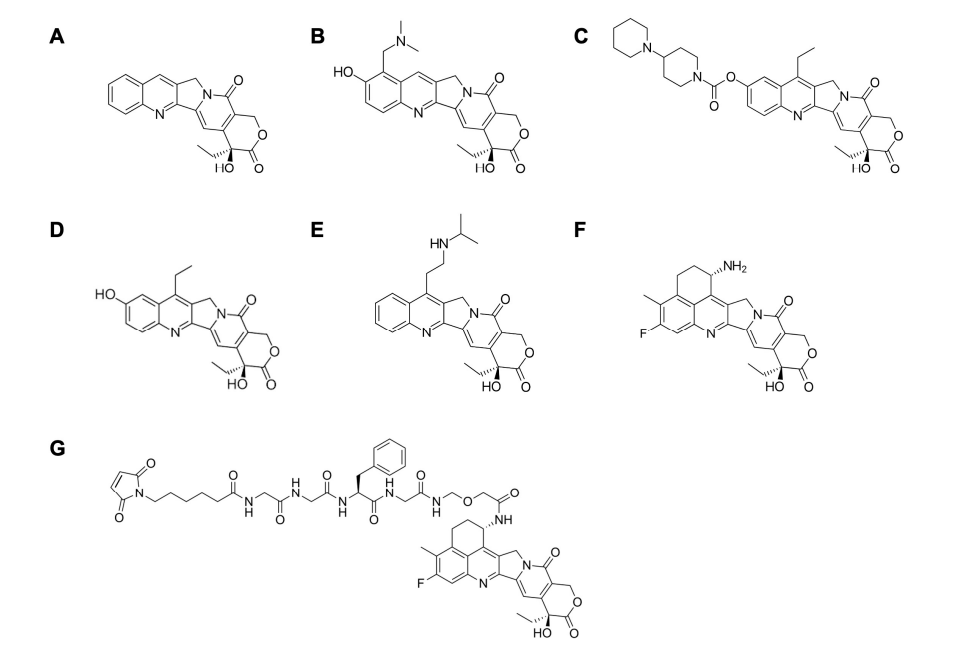
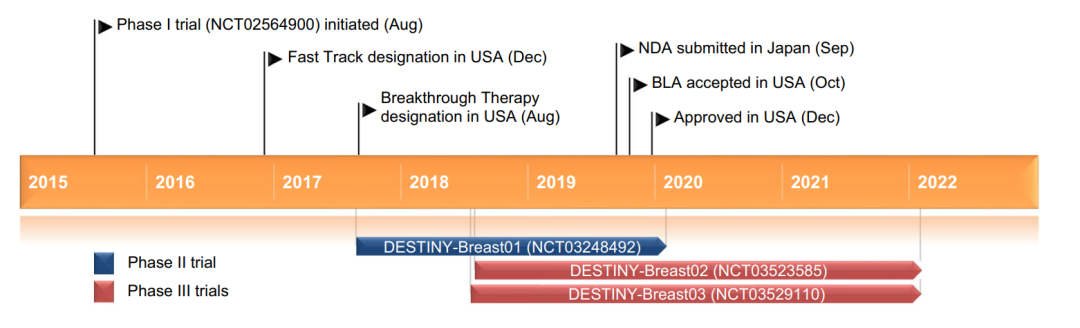
Enhertu®(fam-trastuzumab deruxtecan-nxki) 非臨床研究内容 由抗HER2單抗(IgG1)通過(guò)可切割連接子GGFG(MAAA-1181a)與拓撲異構酶1抑制劑DXd連接組成(chéng)。 DAR爲8,分子量未披露。 适應症:首次申請獲批的适應症爲既往接受過(guò)基于抗HER2方案治療、不可切除或轉移性HER2陽性乳腺癌成(chéng)年患者;後(hòu)續獲批适應症包括:不可切除或轉移性HER2低表達乳腺癌成(chéng)年患者;HER2突變、不可切除或轉移性NSCLC成(chéng)年患者;既往接受過(guò)以曲妥珠單抗爲基礎的治療方案的局部晚期或轉移性HER2陽性胃癌或胃-食管交界腺癌成(chéng)年患者。 用法用量:治療乳腺癌、肺癌的推薦劑量爲5.4 mg/kg/次,治療胃癌的推薦劑量爲6.4 mg/kg/次;所有适應症給藥方案均爲靜脈輸注,21天/次,直至疾病進(jìn)展或出現不可接受的毒性。 Enhertu®(fam-trastuzumab deruxtecan-nxki) 化學(xué)結構,圖源FDA審評報告 Enhertu®(fam-trastuzumab deruxtecan-nxki) 開(kāi)發(fā)的關鍵裡(lǐ)程碑[2] 2016年1月27日,向(xiàng)FDA提交IND 127553以支持啓動I期臨床試驗(DS8201-A-J101)。 2016年11月10日,獲快速通道(dào)資格認定(Fast Track Designation) 用于治療經(jīng)HER2靶向(xiàng)治療(包括T-DM1)後(hòu)進(jìn)展的HER2陽性、不可切除和/或轉移性乳腺癌患者。 2017年8月25日,獲突破性療法資格認定(BTD) 用于HER2陽性、局部晚期或轉移性乳腺癌患者的治療,這(zhè)些患者已接受曲妥珠單抗和帕妥珠單抗治療,并在T-DM1後(hòu)出現疾病進(jìn)展。 2019年10月17日, 獲優先審評資格認定(Priority Review) 用于治療HER2陽性轉移性乳腺癌患者。 2019年12月20日,FDA加速批準(AcceleratedApproval) ENHERTU®, 用于接受過(guò)兩(liǎng)種(zhǒng)及以上抗HER2治療、不可切除或轉移性HER2陽性乳腺癌患者。該上市申請基于如下關鍵性臨床試驗: 在一項多中心、單臂試驗DESTINY-Breast01(NCT03248492) 中,招募了 184 名既往接受過(guò)兩(liǎng)種(zhǒng)及以上抗 HER2 治療的 HER2 陽性、不可切除和/或轉移性乳腺癌女性患者。以5.4 mg/kg每3周靜脈輸注一次,直至出現不可接受的毒性或疾病進(jìn)展。主要療效終點指标采用 RECIST 1.1 标準判定的ORR和DOR。ORR爲60.3%(95% CI:52.9,67.4),CR爲4.3%,PR爲56%;DOR爲14.8個月(95% CI:13.8,16.9)。 分階段支持該産品IND和BLA的非臨床研究内容如下: 備注: 藍色字體:支持首次人體試驗(FIH) IND 申請的非臨床研究 黑色字體:支持後(hòu)續 IND 和 BLA 申請的非臨床研究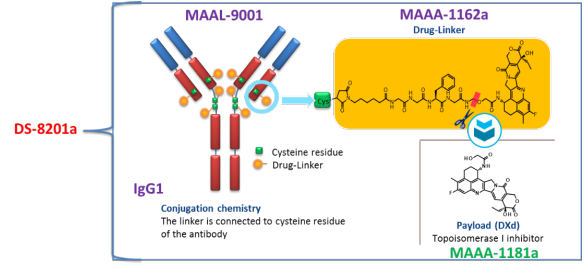

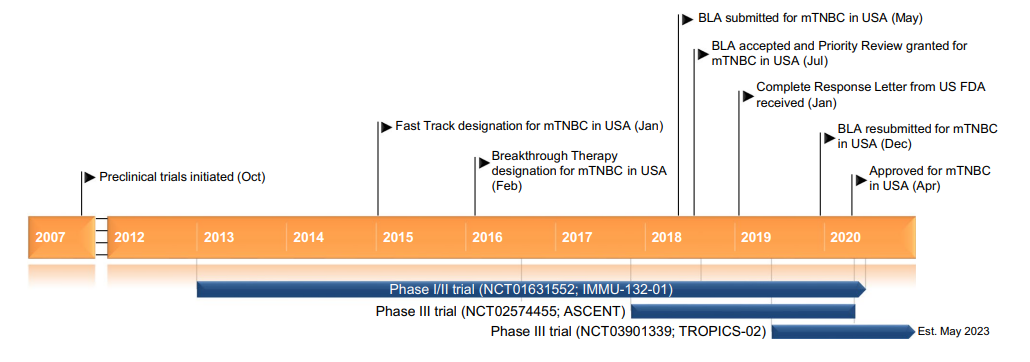
Trodelvy®(sacituzumab govitecan-hziy) 非臨床研究内容 由抗Trop2單抗(IgG1)通過(guò)可切割連接子CL2A 與拓撲異構酶1抑制劑SN-38連接組成(chéng)。 DAR:約7.6,分子量未披露。 連接子:CL2A,可水解。 适應症:首次獲批适應症爲用于治療既往接受過(guò)至少兩(liǎng)種(zhǒng)治療的不可切除的局部晚期或轉移性三陰性乳腺癌(TNBC)成(chéng)年患者,包括至少一種(zhǒng)局部晚期或轉移性疾病的既往治療;後(hòu)續批準的适應症包括:不可切除的局部晚期或轉移性HR陽性、HER2陰性乳腺癌,患者需接受過(guò)内分泌治療和至少兩(liǎng)種(zhǒng)其他轉移性全身治療;局部晚期或轉移性尿路上皮癌(mUC),患者先前接受過(guò)含鉑化療和 PD-1 或 PD-L1 抑制劑。 用法用量:靜脈輸注,推薦劑量爲 10 mg/kg,每周1次,連續21天治療周期的第1天和第8天,直到疾病進(jìn)展或不可接受的毒性。 Trodelvy®(sacituzumab govitecan-hziy) 化學(xué)結構,圖源藥渡 Trodelvy®(sacituzumab govitecan-hziy) 開(kāi)發(fā)的關鍵裡(lǐ)程碑[3] 2012年6月1日,評估sacituzumab (IMMU-132, hRS7-SN38) 治療晚期上皮惡性腫瘤 (IND 115621) 的首次IND申請。 2014年12月22日,獲快速通道(dào)認定用于既往至少接受過(guò)2線治療的TNBC患者。 2016年2月4日,根據IND 122694獲得突破性療法認定用于既往接受過(guò)至少2線治療的治療複發(fā)/難治性、轉移性TNBC患者。 2020年4月7日,獲快速通道(dào)認定用于轉移性尿路上皮癌。 2020年4月22日,FDA批準Trodelvy(sacituzumab govitecan-hziy) 用于既往至少接受過(guò)2線治療的轉移性TNBC: 根據一項針對(duì)108名轉移性TNBC患者的臨床試驗結果批準了Trodelvy,主要終點爲ORR。結果顯示,接受治療的患者ORR爲33.3%,DOR爲7.7個月。在對(duì)Trodelvy有響應的患者中,55.6%維持了6個月或更長(cháng)時間,16.7%維持了12個月或更長(cháng)時間。 分階段支持該産品IND和BLA的非臨床研究内容如下: 備注: 藍色字體:支持首次人體試驗(FIH) IND 申請的非臨床研究 黑色字體:支持後(hòu)續 IND 和 BLA 申請的非臨床研究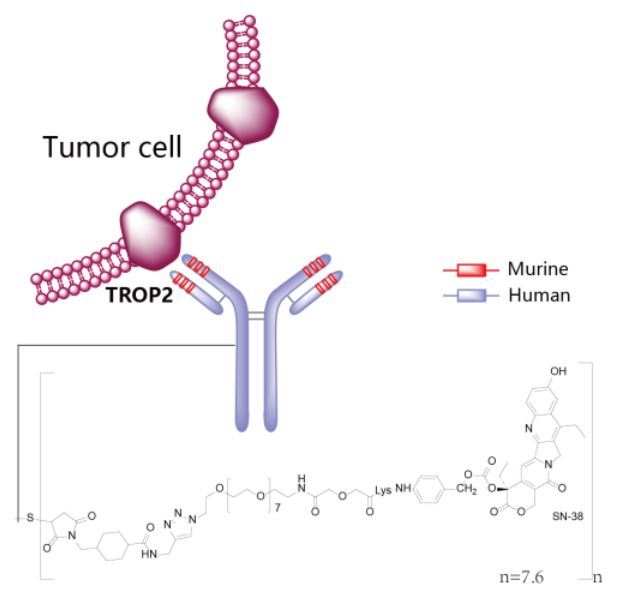

參考資料: [1] Han S, Lim KS, Blackburn BJ, Yun J, Putnam CW, Bull DA, Won YW. The Potential of Topoisomerase Inhibitor-Based Antibody-Drug Conjugates. Pharmaceutics. 2022 Aug 16;14(8):1707. doi: 10.3390/pharmaceutics14081707. PMID: 36015333; PMCID: PMC9413092. [2] Keam SJ. Trastuzumab Deruxtecan: First Approval. Drugs. 2020 Apr;80(5):501-508. doi: 10.1007/s40265-020-01281-4. PMID: 32144719. [3] Syed YY. Sacituzumab Govitecan: First Approval. Drugs. 2020 Jul;80(10):1019-1025. doi: 10.1007/s40265-020-01337-5. PMID: 32529410; PMCID: PMC7288263. 供稿:鼎泰集團轉化科學(xué)和藥政策略部




































