


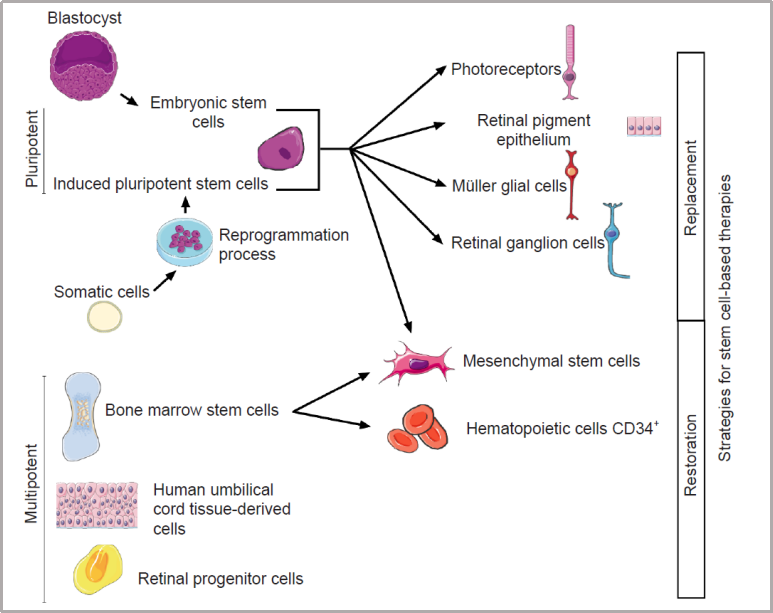
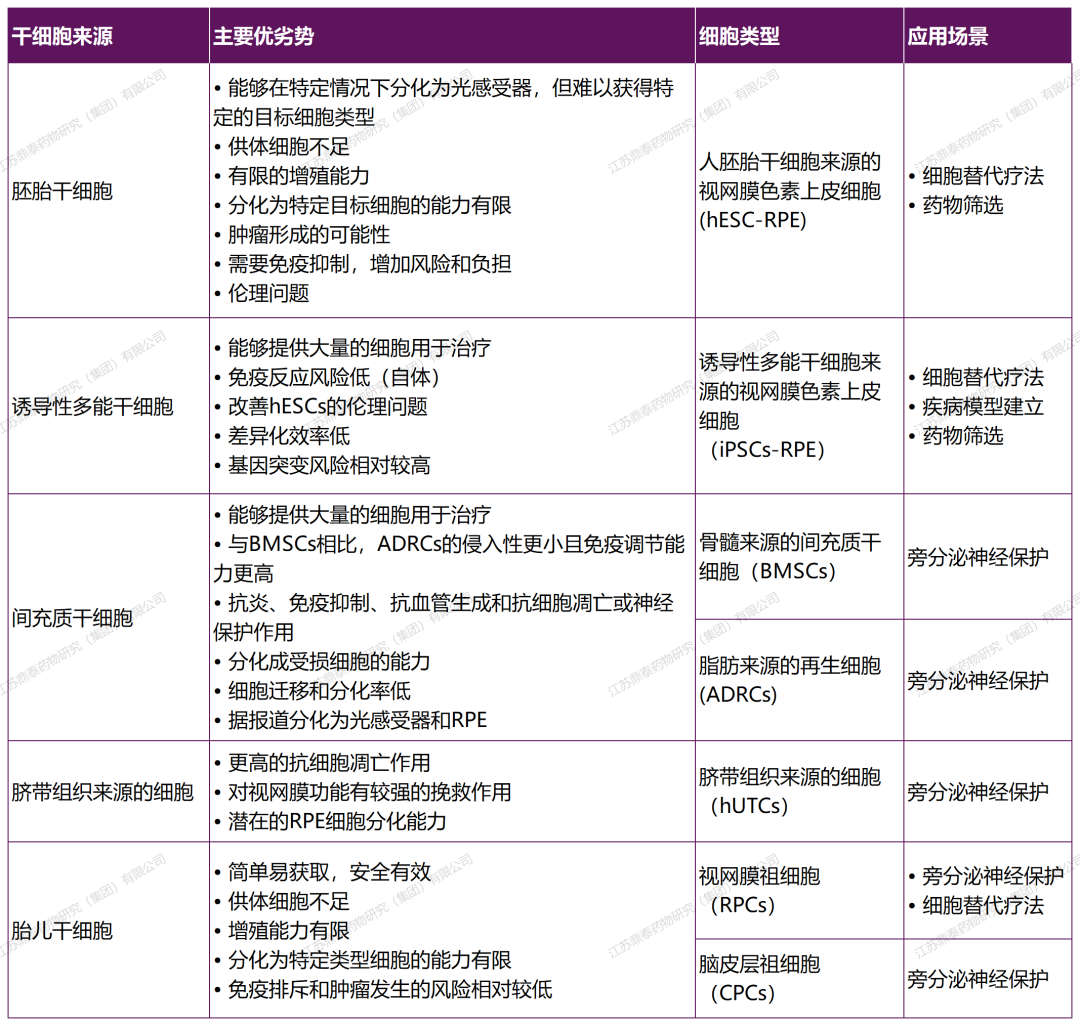
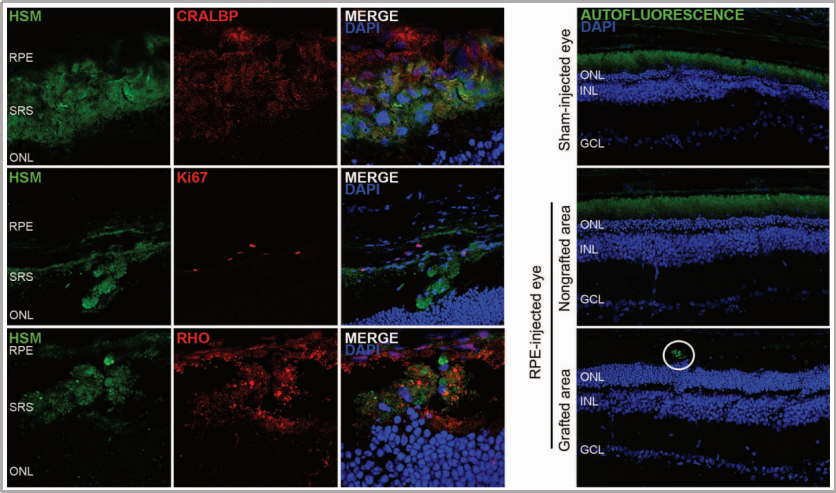
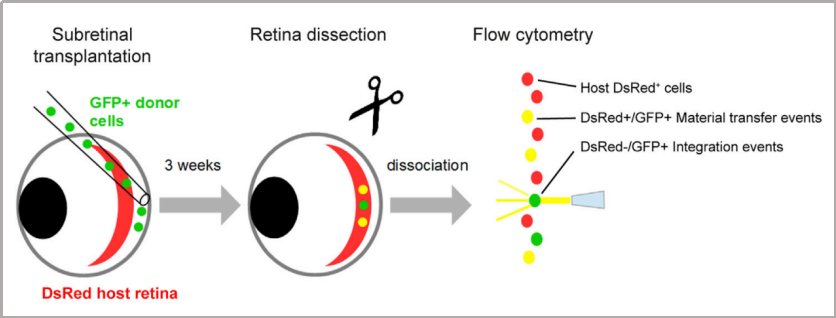
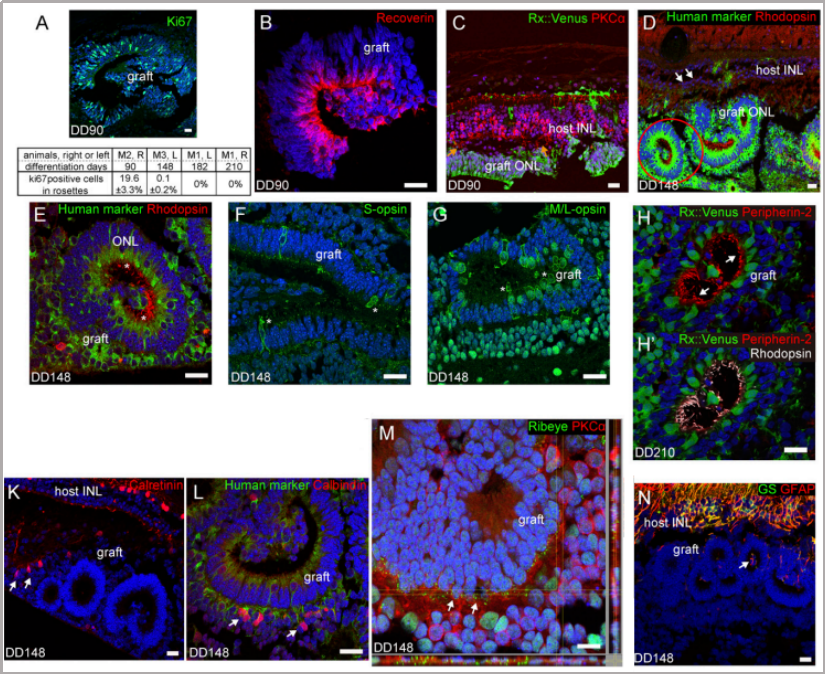
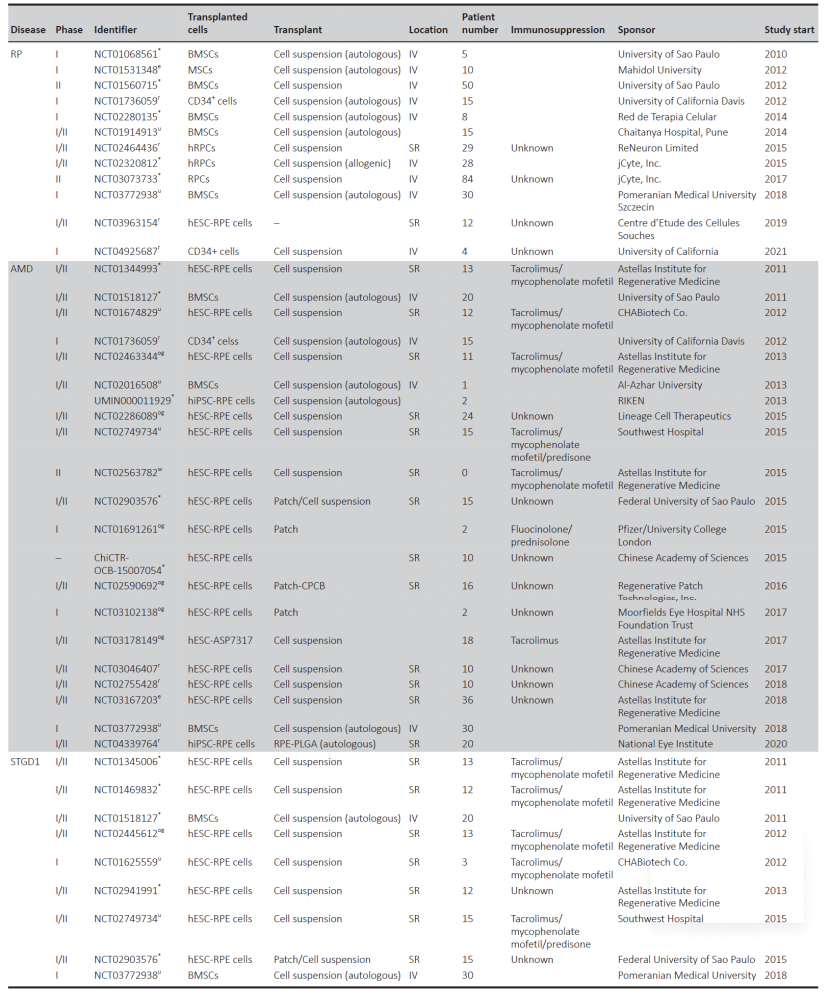
目錄—— 1. 引言 2. 眼科幹細胞治療 3. 細胞來源 3.1. ESCs和iPSCs 3.2. MSCs 3.3. hUTCs 3.4. RPCs 4. 臨床前研究 4.1. hESC/hiPSC來源細胞 4.2. hESC/hiPSC來源的視網膜細胞片移植 5. 臨床研究 5.1. RPE細胞懸液還(hái)是RPE細胞片? 5.2. hESCs-RPE的臨床試驗 5.3. hiPSCs-RPE的臨床試驗 6. 總結 深度學(xué)術文章 全文共9927字 預計閱讀時間25分鍾 引言 視網膜是覆蓋在眼球後(hòu)方的多層平面(miàn)組織。根據胚胎發(fā)育情況,視網膜可分爲兩(liǎng)層:由視網膜神經(jīng)元和神經(jīng)膠質細胞組成(chéng)的神經(jīng)視網膜層以及含黑色素的外層上皮細胞層——視網膜色素上皮細胞(RPEs)。 與RPEs相鄰的是Bruch膜,能(néng)夠讓RPEs緊密連接在一起(qǐ)防止擴散,因此具有血液-視網膜屏障功能(néng),也是形成(chéng)眼部免疫豁免的物質基礎。在靠近神經(jīng)視網膜層的一側,RPEs延長(cháng)出頂突(類似細胞突觸),伸入到光感受器外節段(POS)之間。RPEs的主要功能(néng)是吞噬和消除脫落的POS,維持光感受器的正常更新,以及促進(jìn)視黃醛循環。 神經(jīng)視網膜層由六種(zhǒng)基本的視網膜神經(jīng)元和膠質細胞組成(chéng)。光線必須穿過(guò)整個視網膜,才能(néng)被最外層的兩(liǎng)種(zhǒng)光感受器(PRs)——視錐細胞和視杆細胞檢測到。 光感受器的胞體位于外核層(ONL),其頂端突起(qǐ),形成(chéng)内、外節,位于不同的節層。PRs與位于内核層(INL)的神經(jīng)元産生突觸,形成(chéng)外叢狀層(OPL)。内核層的神經(jīng)元包含雙極細胞(Bipolar cells)、水平細胞(Horizontal cells)和無突細胞(Amacrine cells),負責光誘導刺激的初始處理。最後(hòu),雙極細胞將(jiāng)處理後(hòu)的信息傳遞給視網膜神經(jīng)節細胞(RGCs),兩(liǎng)者之間的突觸形成(chéng)内叢狀層(IPL),而RGCs胞核則形成(chéng)一個獨特的神經(jīng)節層(GCL)。RGCs軸突位于視網膜的最内層,濃縮成(chéng)視神經(jīng),最終投射到大腦的視覺皮層。 圖1. 視網膜結構 視網膜退行性疾病被認爲是導緻失明的主要原因,主要包括年齡相關性黃斑病變(AMD)、視網膜色素變性(RP)、Stargardt病等。此類疾病可以導緻視力持續喪失、視野缺損甚至緻盲。在AMD患者中,傳統抗VEGF治療僅能(néng)靶向(xiàng)滲出性AMD的脈絡膜新生血管,但對(duì)于萎縮性AMD的地圖樣萎縮尚無有效辦法。 近年來,部分基因治療産品表現出對(duì)視網膜萎縮性疾病治療的良好(hǎo)結果,大量基于細胞的治療手段也被開(kāi)發(fā)應用于替代萎縮/凋亡的視網膜細胞從而重塑視覺功能(néng)。哺乳動物的視網膜細胞幾乎沒(méi)有再生能(néng)力,因此可以增殖和分化的幹細胞産品將(jiāng)會是治療視網膜下退行性疾病的新選擇。 眼科幹細胞治療 幹細胞産品用于治療視網膜變性疾病有兩(liǎng)個基本策略: 一是采用幹細胞分化而來的視網膜細胞替代功能(néng)異常的細胞從而恢複視網膜功能(néng)。此策略通常采用人源胚胎幹細胞(hESCs)/人源誘導多能(néng)幹細胞(hiPSCs)來源的光感受器(PRs)、視網膜色素上皮細胞(RPEs)、Müller細胞和視網膜神經(jīng)節細胞(RGCs)。 二是利用幹細胞釋放的神經(jīng)營養因子,消除或挽救導緻視網膜萎縮的因素。此策略通常采用骨髓間充質幹細胞(BMSCs)、人類臍帶組織來源細胞(hUTCs)和視網膜祖細胞(RPCs)。 移植的細胞需要整合進(jìn)視網膜組織長(cháng)期存在并且形成(chéng)新的突觸連接。此外,移植細胞産生的神經(jīng)營養因子能(néng)夠起(qǐ)到保護視網膜的作用。 圖2.幹細胞治療視網膜疾病的兩(liǎng)種(zhǒng)策略 細胞來源 01 ESCs和iPSCs 胚胎幹細胞(ESCs)是來源于囊胚内細胞群的多分化潛能(néng)細胞。在多種(zhǒng)疾病領域,應用ESCs進(jìn)行細胞治療已經(jīng)開(kāi)展了大量的臨床及臨床前研究。然而,hESCs治療的一個主要問題是移植的外源細胞會被宿主免疫系統排斥,避免排斥的一種(zhǒng)替代方法是使用誘導多能(néng)幹細胞(iPSCs)。 iPSCs是通過(guò)不同的方法對(duì)體細胞(如成(chéng)纖維細胞、血細胞和尿液細胞)進(jìn)行重編程而獲得的。與ESCs相似,iPSCs可以誘導分化成(chéng)機體所有細胞。由于iPSCs來自于體細胞,因此不存在ESCs的倫理問題。除了來源于患者自身的體細胞,iPSCs也可以根據人類白細胞抗原(HLA)類型進(jìn)行患者和供體匹配,一定程度上實現了通用型細胞治療方法。 iPSCs用于細胞治療的難點之一就是其重編程過(guò)程。最早的重編程方法是使用逆轉錄病毒載體將(jiāng)四種(zhǒng)轉錄因子(c-Myc、Oct4、Sox2和Klf4)導入體細胞,因此可能(néng)存在遺傳毒性風險。c-Myc作爲一種(zhǒng)原癌基因,有誘導細胞向(xiàng)腫瘤分化的風險,很多研究也已經(jīng)使用了非整合或不含c-Myc的誘導方法。 利用iPSCs進(jìn)行細胞治療也存在一些其他問題,如表觀遺傳記憶。有研究表明,hiPSC-RPEs保留了起(qǐ)源體細胞的基因表達 ”記憶“ ,可能(néng)影響某些細胞特性,如增殖和衰老。此外,由于它們較強的增殖分化能(néng)力,已經(jīng)被發(fā)現了許多嚴重的安全性問題。有報道(dào)指出,未經(jīng)分化或分化不完全的細胞在移植後(hòu)可以産生畸胎瘤,并誘導潛在的免疫反應。 因此,在iPSCs來源的細胞應用于臨床之前,必須制定穩健的分化方案,最大限度地降低細胞異常增殖的風險。 02 MSCs 間充質幹細胞(MSCs)主要來源于兩(liǎng)個成(chéng)熟的器官/組織,骨髓和脂肪。骨髓中除了造血幹細胞(即CD34+細胞),還(hái)存在一類非造血幹細胞——骨髓間充質幹細胞(BMSCs)。 BMSCs能(néng)夠向(xiàng)病變部位遷移,且具有橫向(xiàng)分化能(néng)力,即在特定環境下分化爲其他器官的細胞。RPE細胞受損時會表達特定的趨化因子,誘導BMSCs向(xiàng)受損部位遷移。BMSCs通過(guò)産生神經(jīng)營養因子,發(fā)揮抗炎作用,促進(jìn)細胞存活。 脂肪間充質幹細胞 (ADSCs)又被成(chéng)爲脂肪來源的再生細胞(ADRCs),是一種(zhǒng)非常有前景的幹細胞來源,已經(jīng)在心髒等各種(zhǒng)器官中開(kāi)展了相關研究。與 BMSCs相比,ADSCs更容易從活體捐贈者身上獲取,侵入性較低。此外,它們增殖更快,并表現出更高的免疫調節能(néng)力。 MSCs已被證明具有抗炎、免疫抑制、血管生成(chéng)和抗細胞凋亡或神經(jīng)保護作用。MSCs在治療視網膜疾病中主要是發(fā)揮其分泌神經(jīng)營養因子或抗炎調節劑的作用,促進(jìn)細胞存活。此外,MSCs一樣具有多能(néng)分化潛能(néng)。有報道(dào)指出,BMSCs到達損傷部位後(hòu)可以分化爲視網膜細胞,如光感受器和RPEs,修複受損組織。然而,目前尚不清楚上述分化形成(chéng)的細胞是否能(néng)代表 MSCs 與宿主原本的光感受器融合。 03 hUTCs 人臍帶組織來源的細胞(hUTCs)可分泌生長(cháng)因子(肝細胞生長(cháng)因子、膠質細胞源性神經(jīng)營養因子等)、多受體酪氨酸激酶配體、橋接分子、細胞因子等。hUTCs還(hái)可分泌參與突觸連接和神經(jīng)元生長(cháng)的血小闆反應蛋白。 04 RPCs 視網膜祖細胞(RPCs)是胚胎發(fā)育過(guò)程中視網膜形成(chéng)的起(qǐ)源細胞,是視網膜疾病治療中一個非常重要的細胞來源。RPCs可以從妊娠16至20周的胎兒視網膜中獲得。它們能(néng)夠沿着光感受器譜系遷移和分化,并可能(néng)在退行性視網膜疾病中取代視杆細胞和視錐細胞。RPCs移植既能(néng)通過(guò)分泌增強視網膜存活的營養因子促進(jìn)神經(jīng)保護,也能(néng)直接進(jìn)行光感受器替代。 表1.細胞來源及其在視網膜疾病中的應用 由于目前眼科幹細胞治療的臨床試驗大部分都(dōu)以hESC/hiPSC來源的細胞進(jìn)行移植治療視網膜疾病,本文重點對(duì)這(zhè)一類型的産品作簡要介紹。 臨床前研究 01 hESC/hiPSC來源細胞 自2004年,多項研究報道(dào)哺乳動物視網膜移植hESC/hiPSC來源的視網膜細胞可以使視網膜細胞具備再生潛能(néng)和重新獲得視覺功能(néng)。在視紫紅質敲除的小鼠(rho-/-)中,胚胎視網膜前體細胞眼内移植後(hòu)可以分化爲視網膜系細胞。許多研究表明小鼠ESC/iPSC 來源的細胞移植後(hòu)可以恢複視網膜變性的大鼠/小鼠視覺功能(néng)。hESCs-RPE在大鼠/小鼠模型中移植後(hòu)可以恢複光感受器、改善視覺功能(néng),并且展現出良好(hǎo)的長(cháng)期安全性。 RCS大鼠是一種(zhǒng)遺傳性視網膜變性(Mertk突變)的動物模型,其RPEs存在吞噬功能(néng)缺陷,已廣泛應用于細胞移植的臨床前研究。該模型中,hESC/hiPSC-RPE移植後(hòu)能(néng)夠形成(chéng)RPE層整合進(jìn)宿主的視網膜,并建立緊密連接,發(fā)揮吞噬光感受器外段(POS)的作用,并在移植後(hòu)12周内改善了宿主視網膜功能(néng)。另外,hESC/hiPSC-RPE細胞也有神經(jīng)保護作用,保護視網膜免受細胞變性和神經(jīng)膠質應激的影響。 圖3.RCS大鼠模型,自身熒光(AF)作爲吞噬标記物。(Riera et al., 2016) 視網膜色素變性(RP)是一種(zhǒng)光感受器和RPEs退行性變的視網膜疾病,細胞治療的策略通常是在疾病的早期或中期替換功能(néng)失調或死亡的視錐細胞和視杆細胞。移植物爲前體細胞,需包含極化的外核層(ONL)以及光敏的外節段(POS),細胞軸突延伸到外叢狀層(OPL)并與中間神經(jīng)元(雙極細胞)的樹突形成(chéng)突觸連接,將(jiāng)信号傳遞到視覺通路。 hESC/hiPSC來源的PRs前體移植動物模型視網膜後(hòu)可以觀察到可靠的組織整合并表達光感受器的特異性标志物。自從2011年起(qǐ),大量的研究探索了如何從3D拟胚體中獲得不同發(fā)育階段的光感受器。有研究表明,hESC/hiPSC來源的光感受器前體細胞移植能(néng)夠恢複視覺功能(néng),這(zhè)可能(néng)與移植細胞與宿主細胞間的物質交換有關。這(zhè)種(zhǒng)蛋白質交換以胞質融合爲基礎,并且僅限于PRs和移植PRs的内源性交互作用,從而恢複了功能(néng)異常的光感受器。基于以上原因,前體細胞移植成(chéng)功與否有賴于宿主本身具有一定功能(néng)的光感受器存在,因此對(duì)于宿主視網膜狀态有一定要求。 圖4.細胞間物質交換研究策略。(Waldron et al., 2018) 02 hESC/hiPSC來源的視網膜細胞片移植 與視網膜中的其他細胞不同,RPEs不需要突觸連接,呈單層排列,其發(fā)揮功能(néng)需要細胞之間的緊密連接,并通過(guò)Bruch膜維持離子運輸能(néng)力。Bruch膜是由視網膜色素上皮基底膜和脈絡膜毛細血管基底膜間的膠原纖維所構成(chéng)的結構,可調節兩(liǎng)者間的代謝,維持正常視覺活動。 hESC-RPE細胞片則是將(jiāng)單層極化的RPE細胞種(zhǒng)植在聚對(duì)二甲苯膜上。聚對(duì)二甲苯膜是一種(zhǒng)人造的Bruch膜,能(néng)夠讓RPE細胞産生粘附。這(zhè)種(zhǒng)基質不可降解,具有滲透性,能(néng)夠在視網膜下腔移植後(hòu)穩定存在。有研究人員評價了hESC-RPE細胞懸液和細胞片在大鼠移植後(hòu)的細胞存活和成(chéng)瘤情況。結果表明未觀察到畸胎瘤或異位組織産生,且hESC-RPE細胞片比細胞懸液具有更好(hǎo)的生存率。另一項研究中表明hiPSC-RPE細胞片在大鼠移植後(hòu)可以安全穩定存活并且産生功能(néng)。這(zhè)些研究都(dōu)證明了細胞片移植的可行性,并且與細胞懸液相比,細胞片的系統性分布更低。 3D培養技術的發(fā)展已經(jīng)足以獲得任何分化階段的能(néng)夠自我組裝的多層視網膜組織,并用于移植。目前,人們已建立了多種(zhǒng)可獲得大量用于移植的hESCs/ hiPSC-PRs的 3D培養方案。 有研究評價了小鼠ESC/iPSC來源的3D視網膜組織用于晚期視網膜變性小鼠(rd1)模型移植,結果發(fā)現宿主眼球内生成(chéng)了可再生的視泡以及視網膜神經(jīng)上皮樣層結構,即使在缺乏ONL的模型(rd1)中也發(fā)展出具有完整内外段的結構化ONL,表明在小鼠視網膜下腔移植可形成(chéng)發(fā)育良好(hǎo)的分層視網膜結構。此外,小鼠移植ESC-iPSC來源的視網膜片可以形成(chéng)完整的外核層以及具有光反應的成(chéng)熟光感受器。 靈長(cháng)類動物研究發(fā)現hESCs來源的視網膜片在猴視網膜移植後(hòu)能(néng)夠存活、整合并發(fā)育出結構化的光感受器。另一項研究中,研究人員在一隻猴中發(fā)現hiPSCs 來源的視網膜片移植後(hòu)可以長(cháng)期存活。 圖5.hESC-視網膜片移植的非人靈長(cháng)類模型。(Shirai et al., 2016) 臨床研究 2010年,美國(guó)ACT公司(Advanced Cell Technology)最早獲得FDA批準開(kāi)展細胞治療眼科疾病I/II期臨床試驗,其采用hESC-RPE治療兩(liǎng)種(zhǒng)退行性視網膜疾病:幹性年齡相關性黃斑變性(AMD)和Stargardt病。前期臨床前模型中已證明利用幹細胞治療手段可以挽救視網膜色素變性和預防視力喪失。 01 RPE細胞懸液還(hái)是RPE細胞片? 迄今爲止,臨床試驗的研究主要集中在移植hESC/hiPSC來源的RPEs來預防或減緩視網膜變性。有研究在臨床上評估了兩(liǎng)種(zhǒng)不同的移植物,即RPE細胞懸液和RPE細胞片。RPE細胞懸液移植臨床試驗中目前未觀察到任何嚴重的不良反應,但仍然不清楚該情況下細胞能(néng)否在體内形成(chéng)單層組織。從長(cháng)期療效的角度,移植的RPEs必須極化整合進(jìn)宿主視網膜,并與鄰近的RPEs建立聯系,才能(néng)發(fā)揮其吞噬和物質運輸功能(néng)。然而,視網膜下腔注射可能(néng)會因爲注射形成(chéng)的視網膜裂孔而導緻供體RPEs損失。 因此,RPE細胞片移植可能(néng)是更理想的治療手段。在RPE細胞片中,細胞完全分化,細胞之間直接形成(chéng)連接,其結構接近原生細胞。此外,細胞片的遞送可以降低增生性玻璃體視網膜病變(細胞在玻璃體腔内遷移和增殖導緻視網膜脫離)的風險,這(zhè)也是細胞治療中最嚴重的臨床并發(fā)症。然而,與視網膜下腔注射RPE細胞懸液相比,RPE細胞片也可能(néng)增加視網膜脫離的風險。 爲了臨床應用,Kamao等人開(kāi)發(fā)了一種(zhǒng)方案,用于從hiPSC-RPE細胞中獲得RPE單層膜,不使用任何合成(chéng)支架,而是自行生成(chéng)由IV型膠原和層粘連蛋白組成(chéng)的基膜。在脈絡膜新生血管移除後(hòu)的新發(fā)AMD中,這(zhè)種(zhǒng)技術被證明是有效的,沒(méi)有排斥迹象,患者也無需額外的抗VEGF治療。這(zhè)種(zhǒng)治療手段的主要問題是較高的費用以及漫長(cháng)的準備時間(超過(guò) 10 個月)。 另有研究表明,移植無支架的RPE細胞片導緻RPEs在萎縮區域聚集而無法均勻分布,有支持性支架的RPEs在宿主視網膜中表現出更好(hǎo)的整合。Bruch膜是RPE細胞的一層基底膜,會随着年齡的增長(cháng)而改變,并且會影響RPEs的代謝和附着。有研究團隊把合成(chéng)的超薄聚對(duì)二甲苯作爲基質層模拟Bruch膜的特性,或者使用人類玻璃體結合蛋白修飾的聚酯纖維膜,將(jiāng)RPEs粘附在這(zhè)些材料上進(jìn)行移植。 02 hESCs-RPE的臨床試驗 首例使用hESCs-RPE治療的臨床試驗結果于2012年發(fā)表,入組病人包含13名幹性AMD患者和13名STGD1患者。細胞治療的前3個月需要進(jìn)行全身性免疫抑制以減少免疫排斥。28%的患者都(dōu)發(fā)生了免疫抑制導緻的不良反應。全身免疫抑制劑的使用也可能(néng)導緻尿路感染、胃腸道(dào)症狀或非黑色素瘤皮膚癌等并發(fā)症。在該項臨床試驗中,經(jīng)過(guò)4個月的随訪,沒(méi)有觀察到過(guò)度增殖的迹象。 來自安斯泰來再生醫學(xué)研究所的一項研究招募了18名晚期幹性ADM或STGD1病患者。研究進(jìn)行了12至36個月的随訪,72%的患者仍可在一年後(hòu)觀察到移植的細胞。這(zhè)18名患者中,有10名患者的最佳矯正視力有所提高,1名患者患有葡萄球菌眼内炎和白内障進(jìn)展。未接受治療的對(duì)側眼則未見改善。但考慮到缺乏對(duì)照組來控制安慰劑效應和視力測量的主觀性、樣本量有限、初始視力較差等因素,上述研究結果可靠性仍然存在擔憂。 在另一項研究中,4例患者(2例幹性AMD和2例STGD1)hESC-RPE移植後(hòu)進(jìn)行了1年的随訪,未觀察到不良增殖或緻瘤性,3例患者視力改善,1例未見改變。 我國(guó)重慶第三軍醫大學(xué)西南醫院陰正勤團隊對(duì)7例STGD1患者在治療後(hòu)進(jìn)行了5年随訪,證實了hESC-RPE細胞移植的長(cháng)期安全性和耐受性。 自hESC-RPE細胞移植的首次報道(dào)以來,許多更複雜的重建組織方案被提出,如利用再生醫學(xué)的3D生物工程組織替換受損的細胞或組織;開(kāi)發(fā)RPE薄片或基質材料,使細胞對(duì)手術過(guò)程更耐受,與懸浮細胞相比提高存活率,增加細胞形成(chéng)定向(xiàng)組織的幾率。 Kashani等人設計了一種(zhǒng)使用支架的植入物,稱爲加州治愈失明項目——視網膜色素上皮 1(CPCB-RPE1), 它由 hESC-RPE 細胞的極化單層組成(chéng),附着于超薄合成(chéng)聚對(duì)二甲苯基材上,旨在模拟Bruch膜。參加該研究的五名患者中有四人成(chéng)功接受了CPCB-RPE1移植。在所有植入的受試者中,OCT顯示hESC-RPE和宿主光感受器出現整合。所有移植眼均未出現進(jìn)展性視力喪失,一名患者的視力還(hái)得到改善,另外兩(liǎng)名患者的固視能(néng)力得到改善。hESC-RPE細胞也可以附着在人體玻璃體連接蛋白塗覆的聚酯纖維膜上,然後(hòu)移植到視網膜下腔。在第一項相關研究中,研究人員對(duì)兩(liǎng)例嚴重濕性AMD患者随訪12個月後(hòu),證明了RPE細胞片的有效性和安全性。 03 hiPSCs-RPE的臨床試驗 2013年,日本理化學(xué)研究所(RIKEN)開(kāi)展了首例使用自體hiPSC治療AMD的臨床試驗。該患者未進(jìn)行免疫抑制。術後(hòu)1年,移植片保持完整,最佳矯正視力沒(méi)有改善或惡化,但觀察到黃斑囊樣水腫,未觀察到腫瘤形成(chéng)。第二例患者在其自體hiPSC中觀察到三個單核苷酸變異和拷貝數改變,因此未進(jìn)行治療。但研究者認爲這(zhè)些信息不足以評估其緻瘤性,且并尚未有RPEs發(fā)生轉移性腫瘤的報道(dào)。 在2017年開(kāi)展的另一項自體hiPSC治療濕性AMD患者的試驗中,随訪25個月無不良事(shì)件發(fā)生,但視力沒(méi)有改善。這(zhè)項試驗也有在iPSCs階段發(fā)現突變的情況,相應的患者未進(jìn)行治療。 自體iPSC來源的細胞移植可以避免免疫排斥問題,但由于成(chéng)本和所需的時間,尚未成(chéng)爲一種(zhǒng)标準治療方法。 RIKEN又在2017年爲5名患者移植了HLA匹配的異體hiPSC-RPE細胞。随訪1年後(hòu)未見細胞異常增殖,但出現角膜糜爛(1/5)、視網膜前膜(1/5)、眼内壓升高(3/5)、眼内炎(1/5)、眼内輕度免疫排斥反應(1/5)等不良事(shì)件。盡管如此,上述研究也是第一項證明同種(zhǒng)異體hiPSC-RPE細胞移植的安全性和存活率的研究。 2020年,美國(guó)國(guó)家眼科研究所啓動了一項新的臨床試驗,對(duì)20名AMD患者進(jìn)行了治療,以評估聚乳酸-乙醇酸支架的hiPSC-RPE細胞片移植的安全性。聚乳酸-乙醇酸是一種(zhǒng)具有生物相容性和可生物降解的RPEs移植支架,已被證明可形成(chéng)類似Bruch膜的結構。 表2. 幹細胞産品治療視網膜疾病臨床研究彙總 總結 利用幹細胞産品移植治療視網膜疾病已經(jīng)取得了很大的進(jìn)展,臨床前和臨床研究在一定程度上證明了其安全性。目前還(hái)需要更多的研究對(duì)此類産品的有效性進(jìn)行改善。由于RPE移植後(hòu)需要形成(chéng)有緊密連接的細胞層才能(néng)維持視網膜形态和血-視網膜屏障完整,因此移植RPE細胞片可能(néng)優于移植細胞懸液。在大部分視網膜退行性疾病中,患者視網膜多種(zhǒng)細胞均受累,因此同時移植RPE和或其他視網膜細胞(如光感受器)可能(néng)讓患者的視覺功能(néng)更大獲益。開(kāi)發(fā)複雜的多層視網膜細胞甚至視網膜類器官移植將(jiāng)是這(zhè)一領域的趨勢。此外,移植的手術流程以及術後(hòu)幹預方案也需要在未來被進(jìn)一步優化。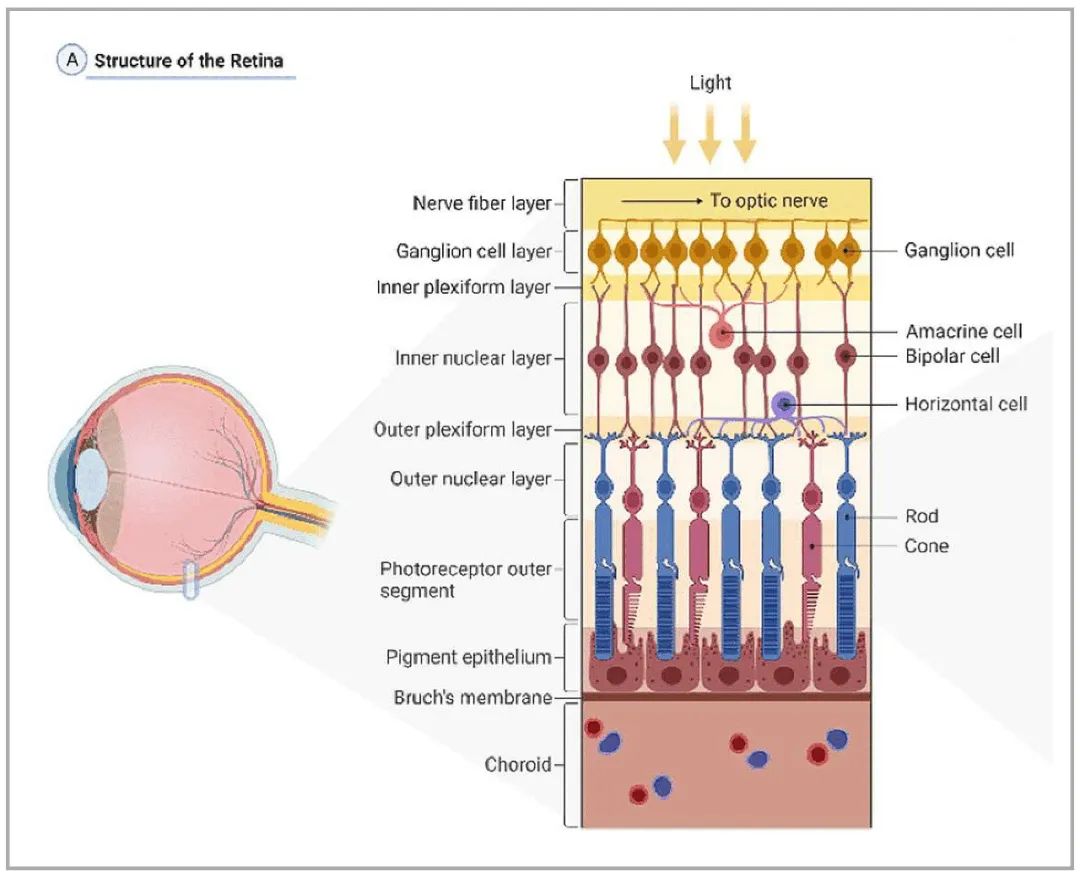
參考資料: 免責聲明:本文來自鼎泰集團内容團隊,歡迎個人轉發(fā)至朋友圈,謝絕媒體或機構未經(jīng)授權以任何形式轉載至其他平台,如需轉載請添加微信LXL--7。本文僅作信息交流而非商業盈利之目的,内容僅供分享學(xué)習。




































